|
 |
EXPERIMENTOS SOBRE LAS LEYES DE LOS GASES |
 |
|
|
|
|
 |
|
Algunos de estos
experimentos proceden del trabajo titulado
"Los Gases",
realizado del profesor Mikel Etxaniz, que obtuvo el
Premio Nacional "Giner de los Rios" en
2004. |
|
|
| |
|
En el
laboratorio del Instituto y en cursos de formación docente
realizamos varios experimentos sobre las leyes de los gases, en
los que se usan
sensores de las magnitudes que determinan su estado (presión,
volumen y temperatura). |
| |
|
Presión y volumen |
| |
|
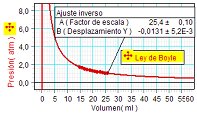
Para estudiar la
relación entre presión y volumen (ley de Boyle) se utiliza un sensor de presión conectado a una jeringuilla graduada. |
| |
|
 |
|
 |
|
Los
estudiantes miden valores de la presión y del volumen
correspondiente del aire encerrado, tomando la
precaución de esperar un poco de tiempo entre las mediciones
con objeto de asegurar que la temperatura del aire
encerrado se equilibre cada vez con la temperatura ambiente y así
permanezca constante.
Clic
aquí para ir al experimento. |
|
|
|
|
Presión y temperatura |
|
|
|
Para estudiar la
relación entre la presión y la temperatura (segunda ley de Gay-Lussac)
se precisa un montaje un poco más sofisticado. Un diseño posible
introduce hielo con sal común en una probeta. Seguidamente, se
introduce en el interior de la probeta la jeringuilla con
aire encerrado y el sensor de temperatura. Desde ese momento se
toman mediciones de la presión del aire encerrado en la
jeringuilla y de la temperatura del agua que la rodea (muy
próxima a la de dicho aire), puesto que dicha temperatura
va aumentando paulatinamente a medida que evoluciona hacia el
equilibrio térmico con el ambiente. |
| |
|
 |
|
Una
buena alternativa, que no requiere usar hielo, es
calentar el aire encerrado en un matraz “al baño María”
después de introducir dicho matraz en un vaso de
precipitados con agua. El sensor de presión se conecta
al matraz y el de temperatura se introduce en el agua.
El profesor Mikel Etxaniz usó este diseño en un
experimento pionero realizado en los cursos 2002-03 y
2003-04. Forma parte del trabajo:
"Los Gases",
Premio Nacional "Giner de los Rios" en 2004.
Clic aquí para ver
una replica actual de este experimento. Tiene el interés añadido de
contrastar el cero
absoluto (se comprueba buscando la temperatura del aire
encerrado correspondiente a una presión nula del mismo). |
|
|
|
|
Presión y número de partículas |
|
|
|
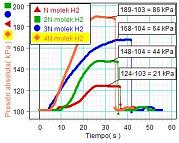
También es
posible estudiar la relación entre la presión y el número de
moléculas, aunque para ello es preciso un diseño
ingenioso, como el propuesto por el
profesor Etxanitz, que usa la reacción química del magnesio (Mg)
con cloruro de hidrógeno (HCl) para producir gas hidrógeno (H2)
en cantidades proporcionales entre sí. |
|
|
|
 |
|
El
diseño experimental conecta al matraz un sensor de
presión dedicado a medir el aumento de presión que
produce el hidrógeno (H2). Ese aumento de
presión representa la presión P que ejercerían
las N moléculas de hidrógeno (H2)
obtenidas tras la reacción si no hubiera aire y,
repitiendo la medición con una masa de magnesio (Mg)
doble, se obtiene la presión P correspondiente a
2N moléculas de hidrógeno (H2), etc.
En el experimento se obtienen unos resultados excelentes
y la práctica resulta muy instructiva al requerir la
consideración de bastantes aspectos de interés.
Clic aquí para ver
el experimento. |
|
|
|
|
Presión, volumen y temperatura |
|
|
|
Se
puede contrastar expresamente la ley de los gases
ideales involucrando simultáneamente en el experimento a tres variables: presión, volumen y temperatura
(para una cantidad fija de gas).
|
|
|
|
 |
|
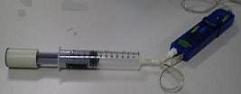
Con el
montaje que muestra la fotografía adjunta, se usan simultáneamente el
sensor de temperatura y el de presión y se toman mediciones
del volumen aprovechando la graduación de la
jeringuilla.
Clic aquí para ir al
experimento. |
|
| |
|
Experimentos con globos |
| |
|
Nos referimos
finalmente a un conjunto de experimentos realizados con globos
en un curso de formación docente, en sesión dirigida por el profesor Vicent Soler del IES "Sixto Marco" de Elche
y completados también por el profesor Mikel Etxaniz. Los globos ofrecen
muchas posibilidades para poner a prueba el modelo
cinético-corpuscular de la materia, no únicamente aplicado a los
gases (al aire encerrado y al aire exterior), sino también al
propio globo, de material elástico. |
| |
|
 |
|
En este
caso se ha estudiado la relación entre la presión
interna de un globo (ejercida por el aire encerrado) y a
la presión externa (ejercida por el aire atmosférico).
El hecho de que también intervenga la
tensión
superficial (ejercida por el propio globo) permite
plantear una serie de experimentos muy interesantes que
arrojan luz sobre el significado e interpretación de
esta propiedad.
Clic aquí para consultar estos
experimentos. |
|
|
| |
Índice |
 |
|
|
|
