|
|
|
 |
|
RELACIÓN
ENTRE EL NÚMERO DE MOLÉCULAS Y LA PRESIÓN DE UN GAS |
|
|
| Experimento
realizado por alumnos de Bachillerato en la Ikastola "Passaia_Lezo" en
Guipuzcoa. |
|
|
|
|
| |
 |
HIPÓTESIS |
|
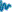 |
OBTENCIÓN
DE CANTIDADES DE GAS CONOCIDAS |
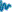 |
DETALLES
DEL DISEÑO EXPERIMENTAL |
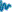 |
RESULTADOS |
 |
ARCHIVOS DE DATASTUDIO |
|
|
|
|
|
|
|
|
HIPÓTESIS |
| |
| |
|
 |
|
Al estudiar el comportamiento físico de los
gases, se plantea, a modo de hipótesis, que la presión de un gas
encerrado en un recipiente ha de depender del volumen, la
temperatura y la cantidad de gas (expresable mediante el número
de moléculas, la masa, la densidad, el número de moles,..).
Manteniendo fijos el volumen y la temperatura del gas, se espera que al ir aumentando la cantidad
de gas, aumente la presión absoluta que
ejerce sobre las paredes del recipiente. Esta hipótesis se fundamenta en el modelo
cinético-corpuscular de la materia, según el cual los gases
están formados por muchas partículas muy pequeñas,
separadas entre sí por grandes distancias en comparación con
su pequeñísimo tamaño, y moviéndose en todas las direcciones
(gas ideal). Según este modelo, la presión ejercida por el gas
se debe a los choques de sus partículas con las paredes del recipiente.
Por tanto, si aumenta el número de moléculas del gas, aumentará
el número de choques. Más concretamente, se espera que la presión ejercida por el gas sea proporcional al
número de moléculas.
El propósito del
experimento es contrastar esta hipótesis |
|
|
|
|
|
|
| |
|
 |
| |
|
OBTENCIÓN DE CANTIDADES DE GAS CONOCIDAS |
| |
| |
|
La primera dificultad
que se ha de superar para realizar
este experimento es encontrar un procedimiento
que permita tener en un recipiente cantidades de gas
conocidas, o que guarden entre sí una
relación sencilla y sean responsables de
la presión ejercida. |
|
|
|
Una forma de lograrlo es aprovechar una
reacción química que se pueda producir
con sencillez
en el laboratorio y que desprenda gas en
cantidades modificables a voluntad. Es
el caso de la reacción del magnesio (Mg)
con cloruro de hidrógeno (HCl). |
|
|
|
Mg (s) + 2·HCl (l) →
H2 (g) + MgCl2 (s) |
|
|
|
Si se tiene cloruro de hidrógeno (HCl)
en exceso, una cierta masa m1
de magnesio (Mg) produce una cierta masa
m2 de hidrógeno (H2),
en la que hay N moléculas de
hidrógeno (H2). Teniendo en
cuenta la
ley de las proporciones constantes o ley
de Proust, una masa doble o triple
de magnesio (Mg) tiene que producir
2·N ó 3·N moléculas de
hidrógeno (H2). No se sabe
cuánto es N, pero así se pueden
producir números de moléculas doble o
triple de un valor dado. Teniendo esto
en cuenta, el diseño experimental
conectará al matraz un sensor de presión
dedicado a medir el aumento de presión
que produce el hidrógeno (H2).
|
|
|
|
 |
|
Ese aumento de presión
representa la presión P
que ejercerían las N
moléculas de hidrógeno (H2)
obtenidas tras la reacción (en
ese volumen V y a esa
temperatura T) si no
hubiera aire. Repitiendo la
medición con una masa de
magnesio (Mg) doble a la
anterior, se obtendrá la presión
P correspondiente a 2·N
moléculas de hidrógeno (H2),
y así sucesivamente.
La
fotografía adjunta pertenece al
trabajo sobre "Los
gases" realizado en los
cursos 2001-02 y 2002-03 por el
profesor Mikel Etxaniz (Premio
Nacional "Giner de los Ríos") y
muestra a los estudiantes
introduciendo el magnesio en un
matraz que contiene la
disolución de cloruro de
hidrógeno. |
|
|
|
|
| |
|
|
|
|
| |
|
 |
| |
|
DETALLES DEL DISEÑO
EXPERIMENTAL |
| |
|
|
|
Comentamos ahora
algunos detalles a tener en cuenta para
optimizar el diseño experimental y superar
algunas dificultades previsibles. |
| |
|
-
Para aportar cantidades
proporcionales de magnesio, es muy
cómoda la cinta de este metal, que tiene
densidad lineal constante. Empezaremos
con una determinada longitud inicial de
cinta, luego el doble, el triple, etc.
|
|
|
|
- Antes de aventurarse a realizar el
experimento conviene hacer cálculos
estequiométricos y estimar la
concentración necesaria de cloruro de
hidrógeno (HCl) para que en un volumen
de disolución razonable (en el caso del
experimento que aquí se comenta fueron
10ml de disolución dentro de un matraz
de 100ml), haya suficiente cloruro para
reaccionar con todo el magnesio (Mg) en
el último ensayo (el de mayor cantidad
de magnesio). Es previsible que los
cálculos indiquen que puede ser
suficiente con cloruro de hidrógeno (HCl)
1M (molaridad igual a uno),
aunque aconsejamos echar un poco más de
cloruro a la disolución desde el
principio, porque si la cantidad es muy
ajustada tarda demasiado en reaccionar
todo el magnesio (Mg). |
|
|
|
-
Después de introducir cada trozo de
magnesio en el matraz, se ha de colocar
el tapón inmediatamente, puesto
que apenas se tarda un par de segundos
en empezar a producir el hidrógeno. Hay
que iniciar la toma de medidas de la
presión P antes de introducir el
magnesio, para apreciar bien la subida
desde el principio. Además, se ha de
sujetar el tapón para que no salte por
el aumento de presión, especialmente con
las cantidades mayores de magnesio. |
|
|
|
-
La
reacción es ligeramente exotérmica, y
como la temperatura T influye en
la presión P, para asegurar que
la temperatura es igual en todas las
mediciones, conviene lavar el matraz con
agua fría tras cada medición y utilizar
siempre una nueva porción igual (en
nuestro caso de 10 ml) de disolución de
cloruro. Una alternativa es que varios
grupos de alumnos realicen
simultáneamente el experimento, cada uno
con cantidades diferentes (que guarden
entre sí una relación proporcional) de
magnesio. Después se pueden analizar los
resultados de todos conjuntamente. |
|
|
|
-
Después de producido todo el H2,
para obtener la presión P
ejercida por N, 2·N, 3·N...
moléculas de hidrógeno (H2),
hay que restar a la presión final la presión inicial
(igual a la presión atmosférica, del
orden de 100 kPa o 1 atm).
Pero, como comprobó el profesor Mikel
Etxanitz cuando realizó por primera vez
el experimento, ocurre que al cerrar el matraz
con un tapón de goma se comprime el aire
del interior y la presión inicial de
éste aumenta ligeramente, antes de
empezar a producirse hidrógeno H2.
Para ver cuál es el aumento debido al
cierre, es necesario que, una vez que la
reacción ha acabado y se ha medido la
presión final P, tras destapar el
matraz, cuando la presión interior
vuelva a ser la atmosférica, se vuelva a
poner el tapón, para poder medir el
aumento de presión debido al cierre, y
restar ese valor a la presión final. Una
vez hecha esta corrección, el valor
experimental de la presión puede ser alrededor
del 90% del teórico (sin hacer la
corrección se pueden calcular
rendimientos imposibles, superiores al
100 %). |
|
| |
|
|
|
|
| |
|
 |
| |
|
RESULTADOS |
| |
| |
|
 |
|
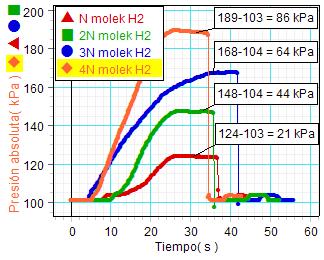
A la
izquierda se recogen en una sola gráfica los
resultados experimentales correspondientes a
cuatro ensayos producidos a base de introducir
en el matraz sucesivamente una longitud inicial
de cinta de magnesio (Mg) de 2 cm, y luego
4 cm, 6 cm y 8 cm (densidad
lineal de la cinta 0,01 g/cm). Al primer
vistazo se aprecia que las gráficas tienen un
aspecto excelente: Muestran el aumento paulatino
de la presión a medida que se va produciendo más
hidrógeno y su estabilización cuando termina la
reacción. Desde ese momento, la medida del
incremento de presión ejercida respecto de la
inicial se corresponde con la presión parcial
del hidrógeno producido (N, 2·N,
3·N y 4·N moléculas).
Otra
cuestión interesante que se observa en
las gráficas es el hecho de que cuanto más
magnesio (Mg) se tiene, antes se empieza a
producir el hidrógeno (H2): El tiempo transcurrido desde que
se coloca el tapón hasta que la presión comienza
a aumentar, es menor cuanto mayor es la masa
inicial de magnesio (Mg). |
|
| |
|
 |
|
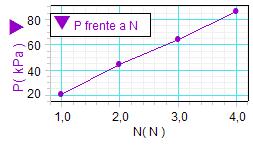
Aunque son sólo cuatro
ensayos, los valores de presión parcial del
hidrógeno obtenidos, puestos en relación con las
cantidades relativas de moléculas, son acordes con la
hipótesis. Se aprecia la bondad de
los resultados realizando una gráfica de la
relación entre la presión y el número de moléculas.
Si se quieren tener más medidas habría que tomar
valores intermedios (con 3, 5 o
7 cm de Mg), porque, una vez superados los
8 cm de cinta (0,08 g de Mg) el
carácter exotérmico de la reacción se pone de
manifiesto de modo perceptible y el aumento de
la presión es notablemente mayor que el que
correspondería al aumento de N (para las
condiciones de este experimento, claro está, con
10 ml de disolución de cloruro de
hidrógeno en un matraz de 100 ml) |
|
| |
|
|
|
|
|
|
 |
|
|
|
ARCHIVOS DE
DATASTUDIO: Puedes descargar el
resultado original del experimento que
se describe en esta página. Para abrir el archivo se necesita el programa DataStudio, del que tienen
licencia bastantes departamentos de Física y Química de
institutos de Enseñanza Secundaria. |
|

