|
|
|
 |
|
LEY DE BOYLE |
|
|
| Experimentos
realizados por alumnos de Bachillerato en el IES Leonardo Da Vinci de
Alicante. |
|
|
|
|
| |
|
|
| |
|
|
|
HIPÓTESIS |
| |
| |
|
Al estudiar el comportamiento
físico de los gases, los alumnos plantean, a modo
de hipótesis, que la presión de un gas encerrado
en un recipiente ha de depender del volumen, la
temperatura y la cantidad de gas (expresable
como número de moléculas, masa, densidad, número
de moles,..).
Acerca de la relación entre presión y volumen
(suponiendo fijas al resto de variables),
consideran que cuanto mayor sea el volumen
de gas, menor debería ser la presión que ejerce sobre las paredes del recipiente y viceversa.
|
| |
|
 |
|
Esta hipótesis se fundamenta en el modelo
cinético-corpuscular de la materia, según el cual los gases
estarán formados por muchas partículas muy pequeñas,
separadas entre sí por "grandes" distancias en comparación con
su pequeñísimo tamaño, y moviéndose en todas las direcciones
(gas ideal). Según este modelo, la presión que ejerce el gas
se debe a los choques de sus partículas con las paredes del recipiente. Al disminuir el volumen,
debería aumentar la frecuencia de estos choques y, por tanto, la
presión. Al aumentar el volumen debería ocurrir lo
contrario. |
|
|
|
De forma
más precisa, se espera que la presión y el
volumen sean inversamente proporcionales (Ley de Boyle).
El propósito del experimento es contrastar
esta hipótesis y el margen de
aplicabilidad del modelo de gas ideal en
relación con la misma. |
|
|
|
| |
|
| |
|
 |
| |
|
DISEÑO EXPERIMENTAL |
| |
| |
|
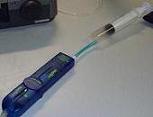
El dispositivo experimental utiliza una
jeringuilla graduada unida a un tubo flexible de plástico,
acoplando el
tubo a su vez (por el extremo opuesto) al sensor de presión. En el momento de encajar estos elementos
queda encerrada
una cantidad de aire, interesando que la posición
del émbolo coincida con la
mayor exactitud posible con una de
las marcas de volumen que indica su graduación. Partiendo de
un volumen inicial, se desplaza el émbolo para comprimir o
expandir el aire. Con el sensor de presión conectado al
ordenador, se obtienen mediciones de las
presiones correspondientes a diferentes volúmenes. |
|
|
 |
|
 |
|
Los montajes adjuntos corresponden a experimentos
realizados por dos equipos en el
laboratorio. Uno usó (en 2009) una
jeringuilla pequeña, con graduación de 0 a 20 ml,
y un tubo bastante largo. El otro usó
(en 2010) una jeringuilla grande, con
graduación hasta 50 ml, y un tubo
(azul) mucho más pequeño. |
|
|
|
| |
|
|
| |
Se ha de tener en cuenta que la ley
que se quiere verificar supone que se mantienen constantes
el resto de variables, es decir, la cantidad de gas y la
temperatura. La constancia de la cantidad de gas está
garantizada por tratarse de aire encerrado en la
jeringuilla. Para asegurar una temperatura constante
conviene esperar un poco de tiempo en cada
medición facilitando que la temperatura del aire
encerrado se equilibre con la del ambiente. |
|
| |
|
|
| |
|
 |
|
 |
|
A la hora de determinar el
volumen del aire encerrado en cada medición, también se ha de tener en
cuenta que la marca
en la jeringuilla indica únicamente al volumen
del aire
dentro de ella y se ha de añadir el
del aire encerrado
en el tubo. Para determinar dicho volumen, los estudiantes
que usaron un tubo largo lo llenaron de
agua (con buen cuidado de no dejar burbujas de
aire) y midieron después el volumen de ese
agua recogiéndolo con otra jeringuilla. Mediante
un simple cálculo matemático se estimó en 2010
que el volumen dentro del tubo corto. |
|
|
| |
|
|
| |
|
 |
|
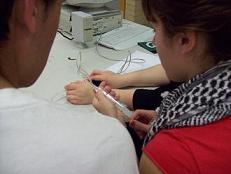
Si se reduce la longitud del
tubo al mínimo, se puede despreciar el volumen
de aire contenido en él frente al de la jeringa.
La imagen a la izquierda corresponde al
experimento que realizó
el profesor Mikel Etxaniz
en el
trabajo "Los gases", que
llevaron adelante estudiantes de 1º Bachillerato durante los cursos
2001-02 y 2002-03 (Premio
Nacional "Giner de los Ríos").
En
este caso, los
alumnos usaban un tubo extremadamente pequeño,
de menos de 2 cm de longitud. En el
experimento actual, además de hacerlo así, han
unido el tubo a una jeringa de 60 ml, con
un enganche semejante al del sensor, que asegura
la estanqueidad. De este modo, se pueden
despreciar esos escasos 1-2 ml frente al
volumen de la jeringa. |
|
|
| |
|
|
| |
 |
|
Finalmente, hay que decir
que, antes
de tomar las mediciones,
se ha de configurar el sensor
para introducir
manualmente los valores
del volumen. De este
modo, el programa va
pidiendo que se introduzca el
volumen correspondiente
a cada medición de
presión que se realiza. |
|
|
| |
|
|
|
|
| |
|
 |
| |
|
EXPERIMENTO Y RESULTADOS |
| |
| |
 |
|
 |
|
Vamos a mostrar
resultados obtenidos durante los tres
últimos cursos (2009, 2010 y 2011) por
diferentes equipos de alumnos en
laboratorios de varios institutos.
Como
veremos, cabe realizar análisis variados
en este experimento, según se relacione
la presión directamente con el volumen o
con la inversa de éste, estudiando
directamente la esperada constancia de
P·V, etc. Esta riqueza de análisis
posibles añade valor al trabajo
experimental. |
|
| |
|
 |
|
 |
|
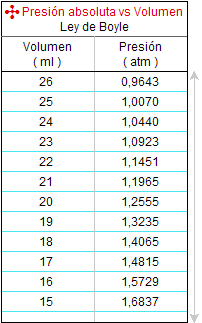
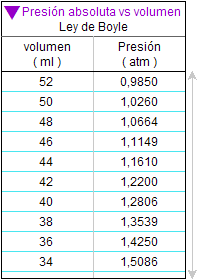
A la izquierda se exponen tablas de valores correspondientes
a resultados obtenidos en 2009 y en 2010
por sendos equipos en el laboratorio del
Instituto.
Lo primero que conviene observar es que
el primer valor de la presión fue 0,964 atm
en 2009 y de 0,985 atm en 2010.
Estos valores concuerdan con lo
esperado, porque la
jeringuilla se cerró en ambos
casos con ese
volumen de aire, por lo que en
la primera medición de presión
dentro de ella
debería coincidir con la
presión del aire del
laboratorio.
El Instituto se
encuentra en la
ciudad marítima de
Alicante, pero está en una zona
alta de la ciudad, por tanto, a un nivel ligeramente
superior al del mar. En el momento de
realizar el experimento el termómetro del
laboratorio marcó una
temperatura de 22 ºC y 21 ºC
respectivamente.
Por tanto, era
lógico esperar una presión
atmosférica cercana y algo
inferior a 1 atm en la medida
en
que se puede considerar que
el aire del laboratorio
tiene unas condiciones cercanas a las llamadas
condiciones normales. |
|
| |
 |
|
 |
|
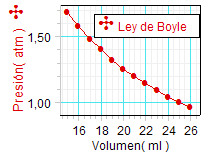
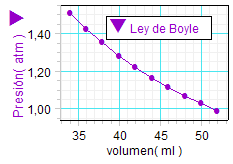
Por lo demás, los
resultados anteriores, representados gráficamente,
muestran para ambos experimentos un perfil
acorde con
la hipótesis en términos cualitativos.
Procede realizar análisis
cuantitativos más detallados para
confirmar el cumplimiento de la ley de Boyle y,
en su caso,
en qué rango de valores lo hace. |
|
| |
|
|
|
|
| |
|
 |
| |
|
ANÁLISIS DE LOS RESULTADOS |
| |
|
|
|
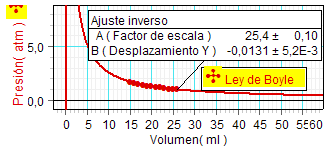
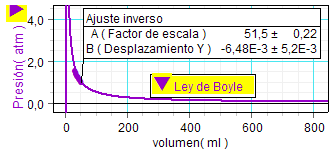
Puesto que la hipótesis
planteada al desarrollar el modelo
cinético-corpuscular es una relación inversa
entre la presión y el volumen, una forma de
proceder es realizar directamente este ajuste matemático sobre los
valores experimentales. Entonces, el programa
define la asíntota vertical a la gráfica
exactamente en el eje de presiones (lo indica
dibujando el eje del mismo color que la
gráfica). |
|
|
|
 |
|
 |
|
Como los resultados experimentales
mostraron que la asíntota horizontal apenas
quedó desplazada del eje de volúmenes (en 0,01
y 0,006 unidades, respectivamente),
podemos concluir que la ley de Boyle
se cumplió con un alto grado de precisión.
|
|
| |
|
Las pruebas que realizaron
todos los equipos mostraron además que, aunque
se comprima el aire todo lo que da de sí la
jeringuilla (hasta encerrarlo casi todo en el tubito
de plástico) el comportamiento del aire
encerrado todavía se corresponde con el de un
gas ideal. |
|
|
|
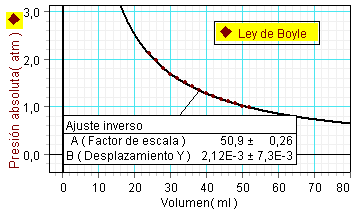
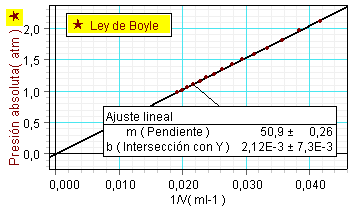
Otra forma de proceder
consiste en estudiar la relación entre la
presión y la inversa del volumen. Puesto que se
espera p·V = K, la relación entre p
y 1/V debe ser lineal, siendo la constante
de proporcionalidad la constante de la ley. Para
hacer este tipo de análisis, primero hay que
definir una nueva variable, igualándola a 1/V
y seguidamente representar la presión frente
a esta variable. |
|
|
 |
|
 |
|
A la izquierda se
muestran resultados obtenidos en 2011
por un equipo de alumnos en el
laboratorio del Instituto.
Como no puede
ser de otro modo, el análisis aporta los
mismos resultados cuantitativos (el
mismo valor de la constante), tanto al
representar p frente a V,
como p frente a 1/V. |
|
|
|
|
El cambio de variable ayuda a
los estudiantes a verificar la ley de Boyle,
aplicando un ajuste lineal y comprobando que la
recta obtenida pasa por el origen. |
|
|
 |
|
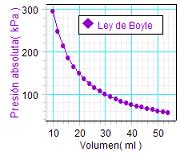
Comentamos
ahora resultados obtenidos
en 2010 por el profesor Mikel Etxaniz
en la Ikastola "Pasaia-Lezo" en
Guipúzcoa.
En este caso
partió de un
volumen de 30 ml, lo que permitió a los alumnos comprimir el gas hasta
10ml
antes de empezar a medir (supone una presión inicial
cercana a unos 300 kPa)
y luego ir aumentando el volumen en 2 ml cada vez hasta acercarse a los
60 ml. De este modo, se dispuso de
un rango de medidas muy amplio, donde la
presión varió desde casi 300 kPa
iniciales hasta 56 kPa
finales. |
| |
|
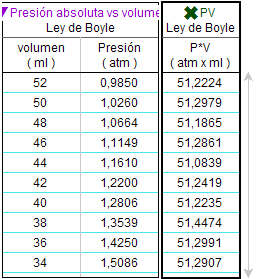
Para analizar si el
resultado se corresponde con la hipótesis, se verificó si la
cantidad P·V se mantiene constante para
los diferentes valores medidos (tabla de
la derecha). |
|
|
|
|
|
|
|
|
 |
|
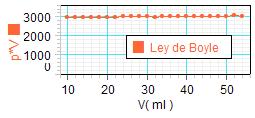
Sobre todo en
ESO, bastantes
estudiantes pueden
tener dificultad para interpretar
la hipérbola o, también, para
hacer el cambio de variable en
el volumen. En
cambio, tal como se observa en
la figura adjunta (a la
izquierda) es muy intuitiva la
constancia del producto de
presión por volumen (P·V = K)
y fija muy bien en ellos la idea de la ley de
Boyle. |
|
| |
 |
|
 |
|
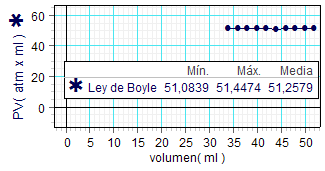
Terminamos el análisis,
usando los resultados obtenidos en nuestro
laboratorio en 2010, para expresar
operativamente la ley. A la izquierda se
muestra la tabla de valores del producto P·V
en este experimento y la gráfica que relaciona
ese producto con las diferentes mediciones de
volumen.
Dicha gráfica, junto con los valores
estadísticos máximo, mínimo y medio de P·V
resaltan con claridad la constancia de este
producto. |
| |
|
Para escribir la ley partimos
de ese valor medio (P·V = 55,26 atm·ml),
con lo que, expresando el volumen en
l, la ley de Boyle queda, (para este
ejemplo) así: P · V = 0,005 526
atm·l (para una cantidad
constante de gas y a una temperatura de
22 ºC o 295,16 K) |
|
|
| |
|
|
|
| |
|
 |
|
|
|
ARCHIVOS DE
DATASTUDIO: Se pueden descargar los
resultados originales de
los tres experimentos que
se describen en esta página. Para abrir los archivos se necesita el programa DataStudio, del que tienen
licencia bastantes departamentos de Física y Química de
Institutos de Enseñanza Secundaria. |
|

