|
|
|
 |
|
LEY DE LOS
GASES IDEALES |
|
|
| Experimentos
realizados por alumnos de Bachillerato en el IES Leonardo Da Vinci de
Alicante. |
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
HIPÓTESIS |
| |
| |
|
Al estudiar el comportamiento
físico de los gases, los alumnos plantean, a modo
de hipótesis, que la presión de un gas encerrado
en un recipiente ha de depender del volumen, la
temperatura y la cantidad de gas (expresable
como número de moléculas, masa, densidad, número
de moles,..).
Acerca de las variables termodinámicas, esperan
que la presión y el volumen sean inversamente
proporcionales, y que la presión y la
temperatura sean directamente proporcionales
(manteniéndose fijas, en cada caso, el resto de
variables). |
| |
|
|
|
Estas hipótesis se fundamentan en el modelo
cinético-corpuscular de la materia, según el cual los gases
estarán formados por muchas partículas muy pequeñas, separadas
entre sí por "grandes" distancias en comparación con su
pequeñísimo tamaño, y moviéndose en todas las direcciones (gas
ideal).
Según este modelo, la presión que ejerce el gas
se debe a los choques de sus partículas con las paredes del recipiente
y la temperatura indica la energía cinética media de las
moléculas del gas.
En consecuencia, al disminuir el volumen,
aumentará la frecuencia de los choques y, por tanto, la
presión. Similarmente, al aumentar la temperatura aumentará la
energía cinética media de las moléculas
del gas, con ella, la intensidad de sus
choques con las paredes del recipiente
y, por tanto, la presión. |
|
|
|
|
De forma más precisa, se espera que la
presión, P, el volumen, V, y la temperatura, T,
verifiquen la siguiente relación: |
|
|
|
P·V/T = K (para
una cantidad fija de gas) |
|
|
|
El propósito del experimento es contrastar
la validez de esta ecuación o ley
de los gases ideales. |
|
|
|
| |
|
| |
|
 |
| |
|
DISEÑO EXPERIMENTAL |
| |
| |
|
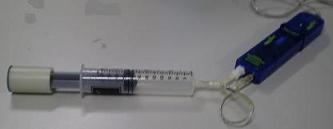
El dispositivo experimental utiliza una
jeringuilla graduada unida a un tubo flexible de plástico,
que se bifurca para acceder a la doble entrada
de un sensor de presión-temperatura. |
|
|
|
 |
|
En el momento de encajar las terminales al
sensor
queda encerrada
una determinada cantidad de aire, dentro de la jeringuilla,
interesando que la posición del émbolo coincida con la mayor
exactitud posible con una de las marcas de volumen que indica su
graduación.
En este caso se plantea partir del mayor volumen
inicial posible, para ir empujando el émbolo (comprimiendo el
aire), con objeto de tomar paulatinamente mediciones de la
presión y la temperatura a medida que va disminuyendo el
volumen.
|
|
|
| |
|
|
| |
|
 |
|
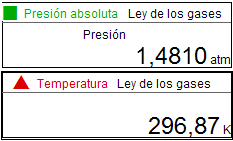
Con el sensor de conectado al
ordenador, se registrarán mediciones de
presión y temperatura, para cada volumen
escogido. Por tanto, los estudiantes configuran
el programa para que solicite cada volumen
(indicado por la graduación de la jeringuilla),
después de detener cada medición de presión y
temperatura.
Por otra parte hay que decir que,
como
en este dispositivo experimental el volumen
encerrado en el tubito de plástico es muy
pequeño, se asume que el volumen
de aire que indica en cada medición la graduación de la
jeringuilla coincide prácticamente con el volumen de aire encerrado.
|
|
|
| |
|
|
|
|
| |
|
 |
| |
|
EXPERIMENTO Y RESULTADOS |
| |
| |
|
Las tres gráficas adjuntas
corresponden al estudio realizado en 2012 por un
equipo de alumnos de 1º Bachillerato. Como se
observa, configuraron el sensor
para medir la presión en atmósferas y la
temperatura en grados kelvin, además de
introducir los valores del volumen en l. |
| |
|
|
| |
|
Al observar las tres gráficas
conjuntamente se intuye que su
perfil cualitativo puede ser acorde con la ley de
los gases que se intenta
verificar, si la disminución
progresiva del volumen se
compensa con el aumento de la presión y la
temperatura. |
| |
|
|
|
|
| |
|
 |
| |
|
ANÁLISIS DE LOS RESULTADOS. VERIFICACIÓN DE
LA LEY DE LOS GASES |
| |
| |
 |
|
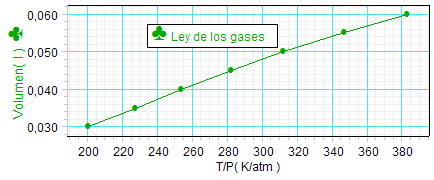
Contrastar si se
verifica la ley de los gases equivale a
contrastar si en cada trío de valores de
las magnitudes termodinámicas, al
multiplicar la presión por el volumen y
dividir entre la temperatura se obtiene
un mismo valor (dentro del margen
experimental). En este caso, para
realizar esta
contrastación, los alumnos optaron
por representar el volumen frente al cociente
entre presión y temperatura.
Como se observa,
obtuvieron un resultado bastante aceptable,
puesto que, si el cumplimiento de la ley de los
gases, exige que dicha representación
proporcione una recta de pendiente positiva (P
debería ser proporcional a V/T). |
|
| |
|
Entre las razones que pueden causar
una desviación de este comportamiento, se ha de
mencionar en primer lugar el hecho de que la jeringuilla
está en contacto permanente con el aire exterior, de
forma que la temperatura del aire encerrado tiende a
disminuir con relativa rapidez para alcanzar el
equilibrio térmico con la del aire del laboratorio. Para
minimizar este problema conviene tomar las lecturas con
la mayor rapidez posible, lo que no está exento de
dificultad, ya que en cada medición es indispensable
esperar unos pocos segundos a que se estabilice de forma
suficiente el valor de la presión. |
| |
|
 |
|
 |
|
Al haber
configurado el programa para
medir la presión en atm,
el volumen en l, y la
temperatura en K, la
relación PV/T proporciona
el valor del producto de n·R
(donde n es el número de
moles de aire encerrado y R
es la constante de los gases con
valor igual a 0,082 en
estas unidades).
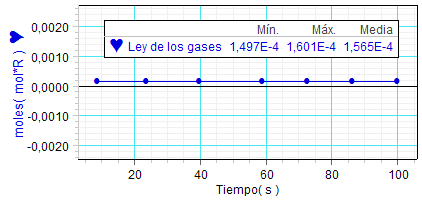
Los estudiantes
también produjeron una tabla con
la cantidad de aire (expresada
en moles) que se deduce de cada
medición y una gráfica que
confirma la bondad de los
resultados al mostrar que los
valores experimentales para
dicha cantidad (n·R) de
moles fueron bastante próximos.
|
|
| |
|
Por último, al dividir el valor medio
de n·R entre el valor de la constante en estas
unidades R (0,082) se obtiene que la
cantidad de aire encerrado en la jeringuilla fue en este
experimento del orden de 1,9·10-3
moles. |
| |
|
|
|
| |
|
 |
|
|
|
ARCHIVOS DE
DATASTUDIO: Puedes descargar el
resultado original del experimento que
se describe en esta página. Para abrir el archivo se necesita el programa DataStudio, del que tienen
licencia bastantes departamentos de física y química de
institutos de enseñanza secundaria. |
|