| |
|
 |
PROPIEDADES PERIÓDICAS I. TAMAÑO
ATÓMICO |
 |
|
|
|
| |
|
La denominación
Sistema Periódico (en lugar de tabla periódica) la
propuso Mendeleiev para poner de manifiesto que la ordenación de
los elementos responde a la ley periódica, es decir, a la existencia de una relación regular entre las propiedades de los elementos
y la
ordenación. Casi al mismo tiempo, Meyer calculó (en 1970) una
propiedad periódica, el volumen atómico, y la usó
para justificar su tabla. |
|
|
|
Ahora
bien, a la hora de cuantificar el tamaño atómico se
ha de tener en cuenta que el átomo no es nada parecido a
una esfera rígida y que su tamaño depende enormemente de
las interacciones a las que se encuentra sometido. En
realidad, de acuerdo con el
modelo mecano-cuántico del átomo los
átomos tendrían en teoría tamaño infinito (no hay
unos límites infranqueables a la localización de los
electrones), aunque también es cierto que es posible establecer contornos de
los orbitales (zonas donde la probabilidad de
encontrarlos es mayor) y, consecuentemente, de los
átomos. |
|
|
|
|
Ya hemos visto
que, en el estudio de Meyer, definió
el volumen atómico (relativo) de cada elemento como la razón entre la masa atómica y la
densidad en su estado atómico más condensado (sólido o líquido). Meyer
dispuso de datos de unos 60 elementos y representó los volúmenes atómicos
obtenidos frente a los números
atómicos, poniendo de manifiesto las regularidades en su
variación. |
|
|
|
 |
|
Hoy es
posible determinar experimentalmente distancias inter-nucleares
y conocer la estructura de bastantes agrupaciones
atómicas.
El radio atómico en estas agrupaciones depende
de las interacciones a las que se ven sometidos los
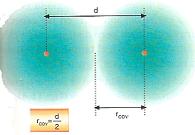
átomos, y, por ello, se define un
radio covalente, igual a la mitad de la distancia
inter-nuclear de los átomos de un mismo elemento unidos
por enlace covalente (figura adjunta), un radio
metálico, igual a la mitad de la distancia entre dos
átomos en un sólido cristalino metálico, y un radio
iónico, igual al de un catión o un anión en
un cristal iónico. |
|
| |
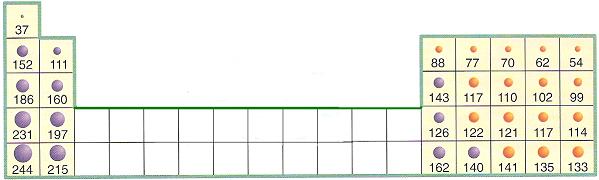
| En la
tabla adjunta (debajo de este texto) se aportan los radios covalentes (color
naranja)
y metálicos (color violeta) de los
elementos representativos del Sistema Periódico. |
| |
 |
|
Como se
ve, la tendencia general en cada familia (columna) es que el
tamaño atómico crece al aumentar el número atómico.
Esto
ocurre porque al aumentar el número atómico pasando de un
elemento de una familia a otro de la misma familia, se incrementa el número
de niveles energéticos del átomo. Los electrones de la
última capa se localizan en un nivel energético superior
a los del elemento anterior de la familia, por tanto,
más alejados del núcleo. |
|
| |
|
En cambio, en
cada periodo la tendencia general es que el tamaño atómico
decrece al aumentar el número atómico. Al aumentar
el número atómico en un determinado periodo no se incrementa el
nivel energético principal de los electrones más externos, pero sí aumenta la carga efectiva del núcleo, lo que supone
una mayor fuerza de atracción del núcleo a los electrones
externos, con la consiguiente disminución del tamaño atómico. |
|
|
|
Además
de conocer volúmenes atómicos totales de los diferentes
elementos de la tabla periódica, para muchas
aplicaciones interesa saber concretamente lo más o menos
"compactos" (en realidad, como sabemos, los átomos están
prácticamente vacíos) que pueden ser unos u otros.
La
figura animada adjunta aporta numérica y visualmente
esta información.
Al hacer clic en la opción "datos",
vemos los valores de los volúmenes atómicos por unidad
de cantidad de sustancia, de todos los átomos del
Sistema Periódico (expresados en cm3/mol).
Seguidamente, podemos hacer clic en varias opciones de
de visualización de cómo se distribuyen estos valores a
lo largo de la tabla periódica: diagrama de puntos,
diagrama de barras y código de colores. |
|
 |
|
|
|
|
 |
|
|
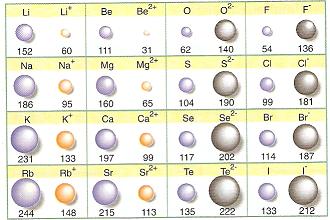
Nos referimos finalmente a los radios iónicos,
para los que se ha de tener en
cuenta que la formación de un ión a partir de un
átomo neutro conlleva una variación en el número
de electrones de la capa de valencia, sin
cambiar la carga del núcleo. |
| |
|
Así, la formación de un catión (ión atómico
positivo) implica la pérdida de
esos electrones [por ejemplo, Na ([Ne] 3s1)
®
Na+ ([Ne])
+ e-], y el radio se reduce
considerablemente . |
| |
|
En cambio, la formación de un anión (ión atómico
negativo) implica la
ganancia de uno o varios electrones [por
ejemplo, F ([He]
2s2 2p5)
+ e- →
F- ([He]
2s2 2p6)].
La repulsión electrónica entre ellos hace que se
alejen lo más posible del núcleo, por lo que el anión
tiene un tamaño considerablemente superior al
del átomo . |
|
|
|
| |
Índice |
 |
|
|
|
|
|
