| |
|
 |
TABLAS
PERIÓDICAS DE MENDELEIEV Y MEYER |
 |
|
|
|
| |
|
En la misma
época en que Newlands planteó la ley de las octavas,
Mendeleiev
(1834-1907) y
Meyer
(1830-1895), cada uno por su lado, y desconociendo ambos el
trabajo de Newlands, trabajaron sobre la posibilidad de
relacionar las masas atómicas y las propiedades de los
elementos. En las publicaciones de Mendeleiev en 1869 y un año
después (1870) en las de Meyer, se encuentra la culminación del
trabajo de décadas anteriores. |
|
|
|
 |
|
Los siguientes
párrafos de Mendeleiev (imagen suya a la izquierda de este
texto) señalan los inconvenientes que habían
evidenciado intentos anteriores de
clasificación basados en propiedades
físicas o químicas de los elementos, y
muestran cómo
reivindicó una ordenación basada en la masa atómica relativa:
"Desde que se sabe que un elemento como el fósforo puede
aparecer en forma metálica o no metálica, resulta imposible
establecer una clasificación fundada en diferencias físicas,
..., hasta hace poco la mayoría de los químicos se han inclinado
en favor de una ordenación de los elementos basada en las
valencias. Pero existe mucha incertidumbre en estos
intentos,...Sin embargo todos saben que cualquiera que sea el
cambio en las propiedades de un elemento, algo permanece
inmutable,... En este aspecto el único valor numérico que
conocemos es la masa atómica del elemento. El primer intento que
hice en esa dirección fue el siguiente: seleccioné los cuerpos
de masas atómicas pequeñas y los ordené de acuerdo con sus
magnitudes; con esto vi que aparecía una periodicidad en sus
propiedades y valencia". |
|
|
|
|
|
Siguiendo esta
línea de trabajo, Mendeleiev publicó su primera tabla
periódica en 1869. En 1872, después de introducir varias modificaciones,
volvió a publicar una segunda tabla más
elaborada, precursora de la actual. |
|
|
|
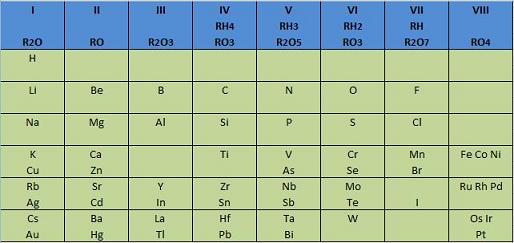
A la derecha se expone el tipo de tabla
periódica que planteó Mendeleiev en 1872. Hubiera
fracasado de no ser porque intuyó que debían existir
elementos todavía no descubiertos y les reservó los
huecos adecuados para mantener
la periodicidad en las propiedades. Dijo:
"Los espacios
vacíos corresponden a elementos que quizá sean
descubiertos en el transcurso del tiempo"
Así
se puede
observar, por ejemplo, que entre el calcio (Ca) y el
titanio (Ti) Mendeleiev dejó un hueco, para que los
elementos que siguen quedaran en la columna que les
corresponde según sus propiedades.
|
|
 |
|
| |
|
Otro
problema que encontró Mendeleiev al plantear su tabla periódica fue que no todos los
elementos, ordenados por su masa atómica, "caían" en el
grupo (columna) adecuado en función de sus propiedades. Para que así
fuera necesitó invertir el orden entre algunos de ellos. Por
ejemplo, la masa atómica relativa del telurio (Te) es superior a
la del yodo (I), pero, considerando sus propiedades, el yodo se
ha de ubicar en la columna VII, que corresponde a la familia de
los halógenos. En la tabla actual existen otras inversiones de
masas atómicas, como las que se vieron al descubrir los gases
nobles [el argón (Ar), por ejemplo, tiene una masa superior al
potasio (K)].
|
| |
|
A pesar de estos
inconvenientes, era claro que la ordenación periódica respondía
a una realidad y ponía en evidencia la existencia de un cierto
orden por debajo de la enorme complejidad de los fenómenos
químicos: la semejanza de las propiedades de los elementos de
una misma columna o grupo y la variación gradual a lo largo de
una fila o periodo. |
| |
|
Propiedades |
Predichas (1871)
|
Observadas
(1886) |
| |
Ekasilicio
|
Germanio |
|
Masa atómica |
72 |
73.32 |
|
Peso específico |
5.5 |
5.47 (20ºC) |
|
Volumen atómico |
13 c.c. |
13.22 c.c. |
|
Color |
Gris sucio |
Gris blanco |
|
Calor específico |
0.073 |
0.076 |
|
Calcinación en
el aire |
EsO2 blanco |
GeO2 blanco |
|
Acción de los
ácidos |
Ligera |
Ninguna acción del HCl |
|
|
Mendeleiev profundizó en la idea de que cualquier
elemento, por pertenecer a la vez a un grupo (vertical)
y a un periodo (horizontal), debía participar de las
propiedades de ambos y ser un promedio de los valores
correspondientes a los elementos que le rodean en el
sistema periódico. Esto le permitió predecir propiedades
de elementos aún no descubiertos. Estas predicciones
tuvieron una brillantísima confirmación cuando se
descubrieron elementos con las propiedades que él había
supuesto.
Como ejemplo, la tabla adjunta recoge la
comparación de propiedades previstas para el elemento
que debía ocupar el hueco
existente justo debajo del titanio (Ti) (al que Mendeleiev
denominó provisionalmente ekasilicio), y las observadas
en 1886 por
Winkler
(1838-1904)
cuando descubrió el elemento que
finalmente ocupó ese lugar: El germanio (Ge). |
|
|
|
|
Además del
germanio, otros elementos, cuyas propiedades predijo
acertadamente Mendeleiev, fueron el galio (Ga), al que llamó eka-aluminio;
el escandio (Sc); y el tecnecio (Tc), que fue el primer elemento
artificial obtenido en el laboratorio, por síntesis química, en
1937. |
|
|
|
 |
|
Nos
referimos ahora al trabajo de Meyer (imagen suya a la
izquierda de este texto), quien en 1970
publicó su propia tabla periódica, muy
semejante a la de Mendeleiev. Para fundamentarla estudió una propiedad común a
todos los elementos conocidos (el volumen atómico) y analizó
globalmente su variación a lo largo del sistema periódico. Meyer aplicó conceptos
adquiridos en los estudios sobre la
estructura cinético-corpuscular de la materia para
determinar volúmenes atómicos
relativos de los elementos: Midió
cantidades numéricamente iguales a la masa atómica de
cada elemento (un gramo de hidrógeno, 16 gramos de
oxígeno,..) y, seguidamente, el volumen que ocupaban esas cantidades a
una misma
temperatura y presión. La diferencia que se apreciaba
indicaba la diferencia del volumen de un elemento
a otro. |
|
|
|
|
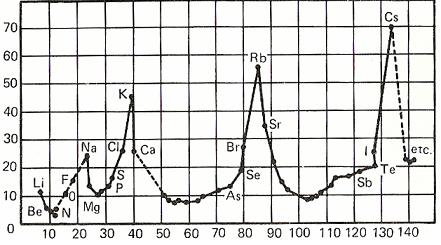
A la
derecha se muestra la gráfica que se obtiene al
representar volúmenes atómicos relativos (relación
entre la masa atómica relativa y la densidad) en función de la masa
atómica relativa de los elementos.
La curvatura resultante
muestra la presencia de grupos por su distribución
periódica con máximos perfectamente definidos desde
donde se desciende a los mínimos a partir de los cuales
crecen nuevamente hasta un nuevo valor máximo. Los
máximos están ocupados por la familia de los metales
alcalinos, de lo que se desprende que
entre ellos debe existir una relación estrecha que
confirma su carácter de grupo.
Al fijarnos en éste o en
cualquier otro grupo
también se observa que, dentro de él, el volumen atómico
aumenta al aumentar la masa atómica relativa. |
|
 |
|
|
| |
Índice |
 |
|
|
|
|
|

