| |
|
 |
DESCRIPCIÓN GENERAL Y PARTICIONES DEL SISTEMA PERIÓDICO |
 |
|
|
|
| |
|
Desde el
establecimiento de la ordenación periódica realizada por
Mendeleiev y Meyer, ha habido numerosas propuestas en cuanto a
la forma de presentar dicha clasificación periódica, siendo hoy
la más aceptada la que se conoce como
tabla larga, que consta
de 18 columnas, denominadas grupos y 8 filas, llamadas periodos.
Sobre esta tabla se suelen considerar dos particiones, que
tienen en cuenta: 1) La configuración electrónica de la última
capa. 2) Las propiedades eléctricas de los elementos. |
|
|
|
Partición de la tabla
según la configuración de la última capa |
|
|
 |
|
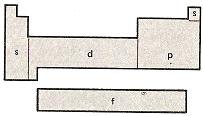
Con este
criterio se puede dividir la tabla en cuatro bloques,
que se relacionan directamente con la estructura
electrónica de la última capa de los elementos. Si nos restringimos
a las ocho columnas principales, los elementos de cada
columna tienen una configuración electrónica semejante y un comportamiento similar. Estos
elementos contienen en su último nivel energético
electrones s o p y se denominan
elementos
representativos. Corresponden a las columnas y
configuraciones electrónicas siguientes: IA ([ ]
s1), IIA
([ ] s2), IIIB
([ ] s2
p1), IVB
([ ] s2
p2), VB ([ ]
s2 p3),
VIB([ ] s2
p4), VIIB
([ ] s2
p5) y, la
última columna o
grupo cero, la de los gases nobles ([ ]
s2 p6). |
|
|
|
|
IA |
Li = [He] 2s1 |
IIA |
Be = [He] 2s2 |
|
IA |
Na = [Ne] 3s1 |
IIA |
Mg = [Ne] 3s3 |
|
IA |
K = [Ar] 4s1 |
IIA |
Ca = [Ar] 4s2 |
|
IB |
Cu
=[Ar] 3d10
4s1 |
IIB |
Zn =
[Ar] 3d10
4s2 |
|
IB |
Ag = [Kr] 4d10
5s1
|
IIB |
Cd =
[Kr] 4d10 5s2 |
|
IB |
Au = [Xe] 4f14
5d10 6s1 |
IIB |
Hg =
[Xe] 4d10 5s2 |
|
|
Como ya
había mostrado Mendeleiev, no
solo hay semejanzas entre los elementos de estas columnas.
Por
ejemplo, los
elementos Cu, Ag y Au (zona d) tienen una
estructura bastante similar a la de los elementos del grupo
IA (Li, Na, K,..), e igual ocurre, para el Zn, Cd y Hg (aunque,
este último, el mercurio, Hg, tiene un comportamiento
bastante particular), con respecto a los elementos del grupo IIA (Be, Mg, Ca,..).
Por ello, siguiendo la nomenclatura original de Mendeleiev,
las columnas de la zona
d que incluyen a estos dos grupos se numeran: IB (Cu, Ag, Au) y IIB (Zn, Cd,
Hg). |
|
|
|
|
En dicha
zona d se puede considerar una octava que columna
(grupo VIII) para ubicar a tres grupos, de tres elementos
cada uno, con comportamiento semejante (los tres de
cada grupo). Son las triadas de Mendeleiev: (Fe, Co y
Ni), (Ru, Rh y Pd), (Os, Ir, Pt). |
|
|
Triada del Fe,
Co y Ni |
|
Fe =
[Ar] 3d6 4s2 |
Co =
[Ar] 3d7 4s2 |
Ni =
[Ar] 3d84s2 |
|
|
| |
|
Bastante más
complejo resulta interpretar la configuración de los elementos
de la zona f, denominados de "transición interna" o
"tierras raras" (lantánidos y actínidos). El estudio
de su comportamiento ha propiciado varias propuestas para la
ubicación de estos elementos y las consiguientes de re-estructuraciones de
la tabla periódica que se exponen en esta
presentación, del profesor Luís Ignacio
García (disponible en
FisQuiWeb). |
| |
|
Partición de
la tabla según la conductividad eléctrica de los elementos |
|
|
|
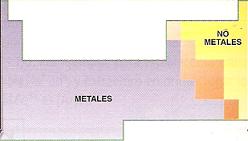
Una segunda
clasificación de los elementos bastante antigua toma como
criterio sus propiedades eléctricas. |
|
|
|
 |
|
De
acuerdo con dichas propiedades, los elementos se pueden
clasificar en metales,
no metales y
semi-metales.
Los
metales son elementos buenos conductores de la electricidad y su
conductividad eléctrica disminuye lentamente con la
temperatura. Los no metales son aislantes eléctricos y
apenas tienen conductividad eléctrica. En cambio, los
semi-metales tienen poca conductividad eléctrica, aunque
superior a la de los metales, siendo su característica
fundamental que dicha conductividad aumenta con la
temperatura. |
|
|
| |
Índice |
 |
|
|
|
|
|