| |
|
 |
ASPECTOS BÁSICOS
DE LA ARQUITECTURA ATÓMICA |
 |
|
|
|
| |
|
En el tema
dedicado a la Estructura
del átomo se exponen los aspectos básicos del
modelo atómico
mecano-cuántico. En dicho modelo, los números cuánticos,
que se obtienen al resolver la
ecuación de
Schrödinger, determinan el número y las características de
los orbitales o zonas del espacio en las que existe probabilidad
de encontrar al electrón. Por otra parte, la energía del átomo
con sus electrones está
cuantizada (sólo puede tener determinados valores), dando lugar a un conjunto de
capas o niveles y subniveles, que se corresponden con los
orbitales posibles.
Por ejemplo, en la capa n=1, se obtiene un sólo nivel de energía con
un orbital de tipo s, en la capa n = 2 cuatro
orbitales, s, px, py, pz , etc.. (ver
tabla
de números cuánticos, niveles y orbitales). |
|
|
|
 |
|
El nivel
de energía de cada orbital depende de la
interacción múltiple que se ejerce entre cada
electrón con el núcleo y con los demás electrones.
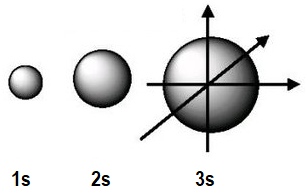
Así,
por ejemplo, recordamos que los orbitales de
tipo s (l=0) se presentan aislados, tienen
simetría esférica centrada en el núcleo y una energía
creciente al aumentar el número cuántico principal, n. |
|
|
|
|
 |
|
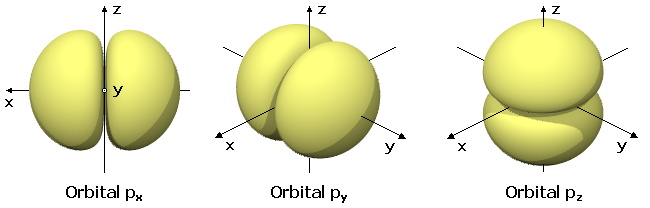
Por su
parte, los orbitales p constituyen en cada nivel un conjunto
de tres muy próximos, que tienen una forma "de cacahuete"
en tres direcciones perpendiculares.
Con esta forma se reduce
al mínimo la repulsión entre ellos al tiempo que
se favorece su proximidad al núcleo.
Más compleja es la
estructura de los orbitales d y f
. |
|
|
|
 |
|
En
general, las interacciones múltiples entre el núcleo y
los electrones aportan gran complejidad al conjunto y
propician un entrecruzamiento de los orbitales de las
distintas capas. Como consecuencia de ello, la
representación de un átomo poli-electrónico con sus
orbitales resulta difícil de plasmar y podría
asemejarse al dibujo adjunto, situado a la izquierda de
este texto.
En cualquier caso, dicha
estructura tiene en cuenta
que el sistema núcleo-electrones tiende a adoptar las
configuraciones de menor energía potencial. |
|
|
|
|
Para un tratamiento cuantitativo de los niveles
energéticos correspondientes a los diferentes orbitales,
se recurre a los
datos espectroscópicos,
que aportan las energías de ionización de los electrones. Con
estos datos en la mano se puede construir un esquema de niveles y subniveles de energía de los átomos de cada elemento.
Lógicamente, los valores de dichos niveles energéticos
son diferentes de un átomo a otro (en cada caso es
distinta la carga nuclear y el número de electrones),
pero ocurre que para la mayor parte de los
elementos, el orden de niveles (según energías crecientes)
es el mismo o muy semejante.
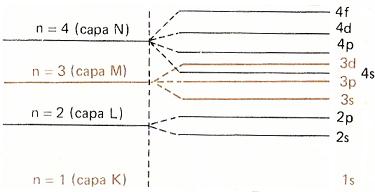
A la
derecha se muestra dicho esquema de niveles para las
cuatro primeras capas. En él se puede observar el entrecruzamiento de
algunos subniveles. |
|
 |
|
| |
|
Al ampliar el
estudio a las siguientes capas, aumenta la complejidad del
esquema, se observa una interpenetración entre niveles de
distintas capas, y la existencia de agrupaciones
de niveles próximos, no siempre coincidentes con las capas. |
| |
|
 |
|
Esquemáticamente, las capas se pueden
representar por el siguiente listado:
1s ... 2s 2p ... 3s 3p ... 4s 3d 4p ... 5s
4d 5p ... 6s 4f 5d 6p ... 7s 5f 6d 6p ...,
etc.
En este listado, los puntos suspensivos separan
cada grupo de orbitales próximos, de forma que
entre grupo y grupo hay un salto energético
más marcado (además, el salto es más acusado entre los
primeros grupos, mientras que las diferencias
van disminuyendo para los grupos superiores).
Es muy conveniente recordar esta ordenación
energética de los orbitales, ya que constituye
el mejor punto de partida disponible para prever
la disposición de los electrones en los átomos. Para hacerlo se tendrá en cuenta que, dados varios
orbitales, tiene menor energía aquél para el que
la suma de los números cuánticos n+l tiene un
valor más bajo y, en el caso de que dicha suma
coincida, tiene menor energía el de más bajo
número cuántico principal, n.
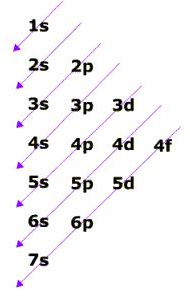
El diagrama
adjunto (a la izquierda) refleja una regla
nemotécnica muy utilizada para ordenar los
orbitales, aunque resulta incompleta porque no
indica los intervalos para los que los saltos
energéticos son mayores.
|
|
| |
|
Se ha de tener en cuenta
que esta ordenación energética no
responde a una ley inalterable y
sufre modificaciones en algunos elementos de número atómico elevado.
Además, se aplica únicamente a átomos aislados, no sometidos
a interacciones. La estructura electrónica de los átomos se puede
ver profundamente modificada por la acción de otros, como ocurre con
frecuencia, en los compuestos. |
| |
|
Nos referimos
finalmente al llamado principio de exclusión de Pauli
(1900-1958), que expresa que cada electrón en el átomo tiene un
conjunto único de números cuánticos. Es decir, dos electrones,
en el mismo átomo, no pueden tener los mismos valores para n,
l,
m y s. Por tanto, una nube electrónica u orbital (caracterizado
por los valores de n, l, m) sólo puede
existir con uno o a
lo sumo dos electrones (con valores de espín contrarios).
Teniendo esto en cuenta, se suele escribir el listado de niveles
de energía permitidos indicando con un superíndice el número
máximo de electrones que pueden formarlos: |
|
|
|
1s2 ... 2s2 2p6 ... 3s2 3p6 ... 4s2 3d10 4p6 ... 5s2
4d10 5p6 ... 6s2
4f14 5d10 6p6 ... 7s2 5f14 6d10 6p6 ... |
|
|
|
Este listado
esconde la información acerca de los diferentes orbitales de
cada nivel y tipo. Por ejemplo, al escribir 2p6
se quiere indicar los tres orbitales de tipo p de la
capa 2. Como hemos dicho, estos orbitales son perpendiculares
entre sí y teniendo en cuenta el principio de exclusión de Pauli
pueden existir (cada uno de ellos) con uno o a lo sumo dos
electrones (de espines opuestos). Se puede indicar todo esto
escribiendo: 2px2 2py2 2pz2 |
|
| |
Índice |
 |
|
|
|
|
|


