|
|||||||||||||||||||||||||||
|
Nos referimos ahora a otra importante dificultad del modelo de Rutherford: No podía explicar los resultados de los estudios sobre los espectros atómicos. Estos resultados ya eran conocidos cuando se formuló el modelo y sugerían que los electrones en el átomo sólo pueden tener unas determinadas cantidades de energía. Este hecho se relaciona con la disposición de los electrones en volumen atómico a la que el modelo de Rutherford no impone ningún tipo de restricción. En principio, los electrones podrían situarse a cualquier distancia del núcleo. |
|||||||||||||||||||||||||||
|
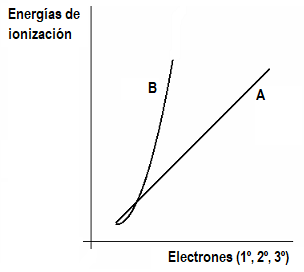
Para obtener información empírica sobre la disposición de los electrones en el átomo se puede determinar el trabajo que se necesita para arrancar o extraer cada uno ellos, lo que se llaman energías de ionización (la primera energía de ionización es la mínima energía que hay que suministrar a un átomo neutro, en su estado fundamental, para arrancarle un electrón; la segunda energía de ionización es la energía precisa para sustraer el segundo electrón y así sucesivamente) |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
Los estudios de los espectros atómicos permitieron dar una respuesta experimental a esta cuestión. La espectroscopía se había iniciado en el siglo XVII con el experimento del prisma de Newton (1665), en el que comprobó que la luz blanca se descompone en el espectro de colores del arco iris. Y se desarrolló en los siglos XVIII y XIX, cuando el prisma inicial usado para descomponer la luz fue reforzado con rendijas y lentes telescópicas, consiguiendo una herramienta más potente y precisa para examinar luz procedente de distintas fuentes. |
|||||||||||||||||||||||||||
|
En 1814, Fraunhofer (1787-1916), utilizó un telescopio y un difractómetro diseñado por él mismo, para investigar por primera vez con detalle las líneas de absorción en el espectro del Sol. Lo hizo siguiendo indicaciones de Wollaston (1776-1828), un físico inglés que había descubierto en él rayas oscuras. Fraunhofer enumeró con exactitud 754 de esas líneas, que desde entonces se denominan líneas de Fraunhofer.espués de Fraunhofer, se concede a Bunsen (1811-1899) y a Kirchhoff (1824-1887) el principal mérito de haber desarrollado en 1959 el espectroscopio para estudiar la luz generada en laboratorio mediante el calentamiento de diferentes fuentes como gases, metales y sales. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
Como resultado de sus experimentos, Kirchhoff planteó tres leyes empíricas que describen la emisión de luz por objetos incandescentes. Estas leyes ponen de manifiesto que cada átomo produce un espectro de emisión y otro de absorción, que son característicos y discontinuos. La discontinuidad de las rayas implica una discontinuidad de las energías que cada átomo emitir y absorber. Dichas cantidades de energía se emiten o absorben cuando alguno de los electrones aumenta o disminuye su energía cinética y potencial. El conocimiento del espectro permite deducir las energías de ionización del átomo. |
|||||||||||||||||||||||||||
|
Para dejar una huella permanente de un espectro, la luz que ha sido descompuesta por el prisma se hace incidir sobre una placa fotográfica, donde quedan impresionadas las rayas. La colocación de cada raya indica su frecuencia, mientras que su intensidad se determina por el grado de ennegrecimiento de la placa. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
Al comprobar que era similar a la línea emitida en el laboratorio por sodio incandescente, concibieron la idea de utilizar el análisis espectral de la luz procedente del Sol para deducir la composición solar. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
Tras analizar estas energías y representarlas gráficamente se observa que sus valores no se corresponden con una disposición aleatoria de los electrones a diferentes distancias del núcleo. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
Los espectros de otros átomos producen resultados similares, en el sentido de indicar que a todos les es aplicable la idea de distribución de los electrones en capas. Se constata además que cada capa o nivel de energía puede tener un determinado número máximo de electrones (2 la capa más interna, 8, la segunda, otros 8 la tercera,..) y que en su estado fundamental o de mínima energía, los electrones de cada átomo ocupan las capas electrónicas o niveles de energía accesibles en orden creciente. |
|||||||||||||||||||||||||||
|
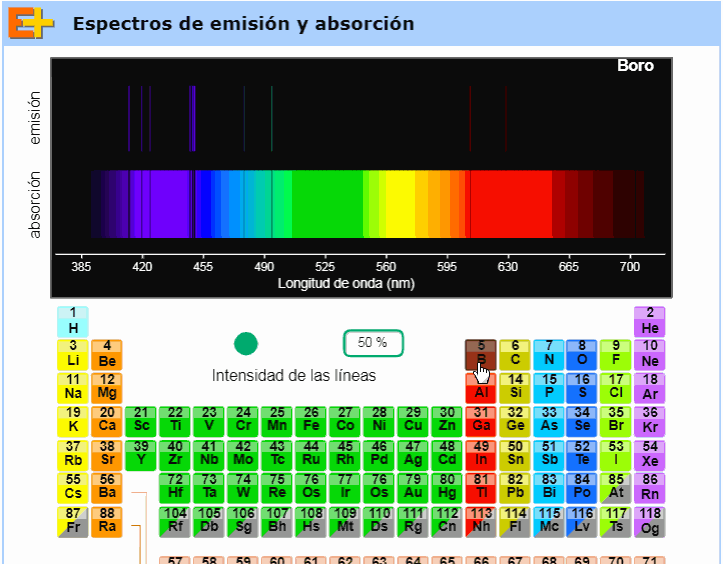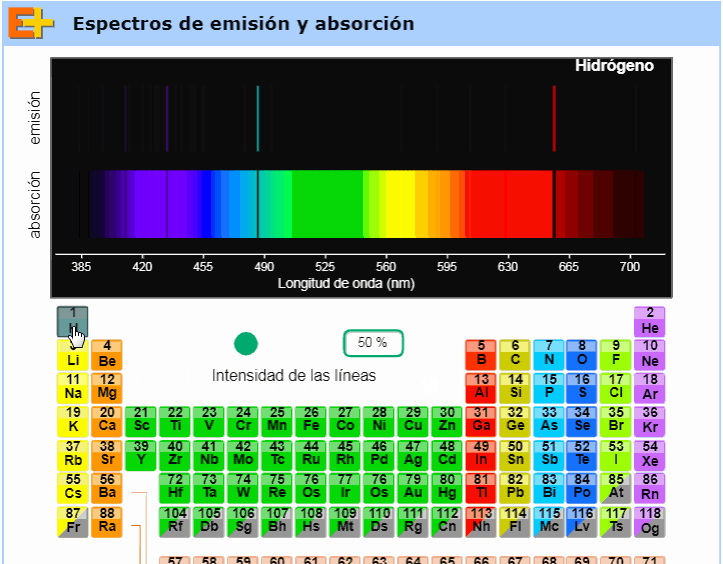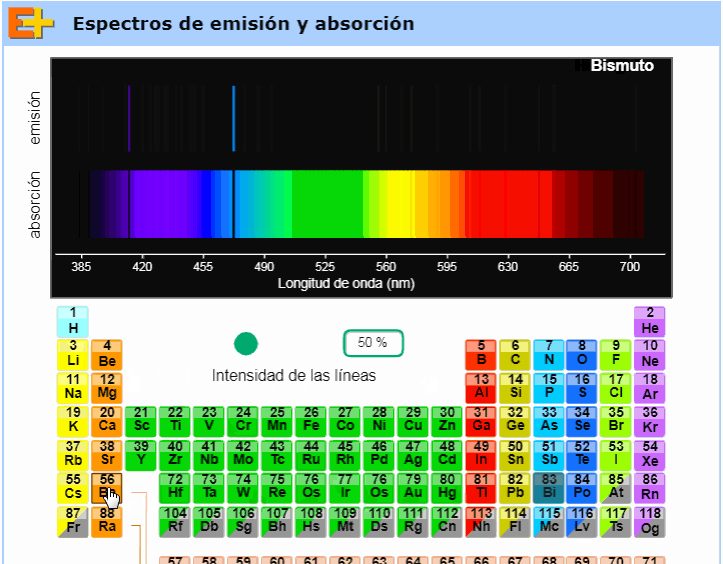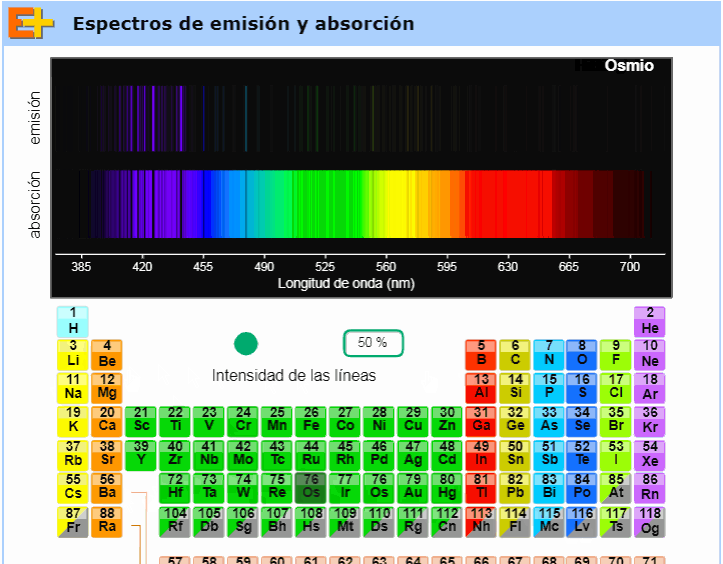
Debajo de este párrafo (totalmente a la derecha) puede verse un gif tomado de una animación muy interesante de la página web Educaplus, obra del profesor Jesús Peñas. Como vemos en ese pequeño clip de video, dicha animación permite al usuario elegir cualquier elemento de la tabla periódica y nos muestra entonces sus respectivos espectros de emisión y absorción. Aconsejamos visitar esta excelente página web y usar en el aula, en particular, esta animación (disponible aquí). |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
El espectroscopio cuantitativo como instrumento para la construcción y uso de modelos de emisión y absorción de radiación en física cuántica (Artículo de F. Savall-Alemany, J.L. Domenech y J. Martínez Torregrosa, 2014) |
|||||||||||||||||||||||||||
|
Espectroscopía fácil en el laboratorio de bachillerato (Artículo de Andrés García-Verdugo, 2022) |
|||||||||||||||||||||||||||
|
Índice |