| |
|
 |
ESTRUCTURA ATÓMICA Y MAGNETISMO |
 |
|
|
|
| |
|
Cuando se descubrió que las
corrientes eléctricas producen campos magnéticos, se abrió el
camino a la interpretación del
magnetismo natural, puesto que, como es lógico, se pensó que
éste
también debía estar asociado al
desplazamiento de cargas en el interior de los imanes. A partir
de esta idea inicial, el modelo explicativo del magnetismo
natural ha ido evolucionando conjuntamente con la evolución de las
teorías sobre la Estructura interna de la materia. |
| |
|
 |
|
Haremos aquí una
interpretación simplificada con referencia al
modelo actual
mecano-cuántico del átomo. Dicho modelo atribuye a
los electrones en el átomo propiedades magnéticas por dos motivos:
- En primer lugar, considera que
los electrones en su movimiento
dentro del átomo, aunque no se les puede atribuir una
órbita definida, equivalen a una corriente
eléctrica y, por tanto, producen un campo magnético.
En 1896
Zeeman
(1865-1943) y
Lorentz (1853-1928)
pusieron en evidencia este hecho
cuando comprobaron que la acción de un campo
magnético exterior produce en el átomo un
desdoblamiento de las líneas espectrales
asociadas a cada tipo
de orbital, s, p, d o f
(efecto Zeeman).
El tercer
número cuántico, o número cuántico magnético,
m, se introdujo para dar cuenta de este hecho y puede tomar un
número impar de valores, correspondientes a las
diferentes orientaciones que puede adoptar el
campo magnético de cada tipo de orbital cuando se ejerce
sobre el átomo un campo magnético externo.
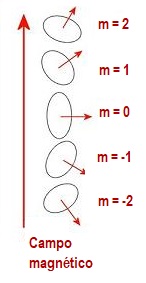
La figura adjunta recuerda los
desdoblamientos del subnivel para l = 2,
u orbital de tipo d. En este caso, m, puede
tomar cinco valores, desde -l hasta +l (-2,
-1, 0, 1, 2), lo que implica que hay que considerar
5 orbitales de tipo, d, y otras tantas orientaciones del
pequeño imán a que equivalen. |
|
| |
|
- Adicionalmente,
el modelo cuántico del átomo considera al electrón en sí mismo
como un objeto no
puntual que produce campo magnético. Cada uno de los dos
electrones que pueden conformar un orbital sólo puede
tener una entre dos orientaciones magnéticas opuestas. Este efecto es más intenso que el anterior. |
|
|
 |
|
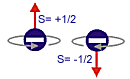
Este hecho se puso en evidencia cuando se observó un segundo
desdoblamiento de las líneas espectrales que produce un
doblete (dos líneas) para cada orbital (efecto Zeeman anómalo).
El
estudio de estos dobletes indujo en 1925 a
Uhlenbeck (1900-1988) y
Goudsmit
(1902-1978) a introducir el cuarto
número cuántico, o
espín, s, que puede tomar dos valores
(+1/2 o -1/2). |
|
| |
|
Así pues, el electrón, en el
átomo, se ha de considerar como un pequeñísimo imán. Para dar
cuenta de esta cualidad se introdujo la magnitud
momento magnético, un vector que, en presencia de un campo
magnético externo se relaciona con el
momento de fuerza tras la reorientación de ambos vectores (el
momento magnético del electrón y el campo externo aplicado).
Teniendo en cuenta lo expresado unas líneas más arriba, se considera un
momento magnético orbital y un momento magnético de
espín. |
|
|
|
Poco después de conocerse el
efecto magnético del electrón en el átomo, se puso de manifiesto
que tenían un momento magnético no nulo otras partículas (por
ejemplo el protón) y agrupaciones de ellas (por ejemplo, el
núcleo atómico). Finalmente, se dio un paso más, concluyendo que
el momento magnético de espín es una propiedad intrínseca
o fundamental de las partículas, como lo es la masa o la carga
eléctrica. |
|
| |
Índice |
 |
|
|
|
|
|

