| |
|
 |
ESPECTRÓGRAFO DE MASAS |
 |
|
|
|
| |
|
 Aston (1877-1945)
Aston (1877-1945) |
 Espectrógrafo de Aston
Espectrógrafo de Aston |
|
El espectrógrafo de masas es un dispositivo
experimental que permite separar iones de átomos
y/o moléculas en función de su masa. Se compone de una
cámara donde se producen los iones, un pequeño
acelerador lineal donde un campo eléctrico les
aplica una
diferencia de potencial, y la zona de detección donde
un campo magnético los separa, antes de que
incidan sobre una placa de detección
(normalmente una placa fotográfica). Lo inventó
Aston (1877-1945)
en 1919 y lo utilizó para identificar, separándolos en base a la diferencia de sus
masas, un gran número de isótopos (hasta
entonces desconocidos) de elementos
no radiactivos. Así
descubrió hasta 212 de los 287 isótopos
naturales y aportó la regla que lleva su nombre, que
afirma que los elementos atómicos de número
impar no pueden tener más de dos isótopos
estables. En
1922 recibió el premio Nobel de Química. |
|
|
|
|
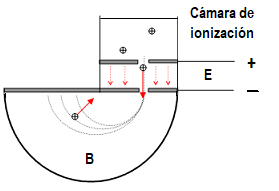
A la derecha se muestra un esquema
simplificado del espectrógrafo de masas. Para
investigar sus isótopos naturales se
introduce un
elemento, previamente vaporizado, en la cámara
de ionización, donde se le inyectan
electrones que ionizan sus átomos. Los iones obtenidos
(positivos) son acelerados por el
campo eléctrico E y, después de
pasar por el orificio de la placa negativa del
acelerador, entran en la zona de detección, donde se les aplica
un campo magnético B, perpendicular a su
velocidad. La
fuerza magnética de Lorentz curva su
trayectoria, dependiendo el radio de
curvatura de la relación entre la masa y la
carga de los iones.
Así, por ejemplo, si el elemento
analizado tiene tres isótopos
naturales, el ión de cada uno (con masa
diferente) se detectará en un lugar diferente de
la placa, tal como se representa en el dibujo
adjunto.
|
|
 |
|
|
|
|
|
Las ecuaciones
relevantes en este proceso son la expresión que relaciona la energía cinética que adquieren los iones en el
acelerador con el potencial
eléctrico que se les aplica ahí (m·v2/2 = q·V)
y la expresión que calcula el radio de curvatura de la trayectoria circular que
siguen los iones en la zona de detección (R = m·v/q·B).
Combinando ambas,
se obtiene la siguiente expresión para la relación entre la masa y
la carga del ión:
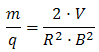 |
|
|
|
|
|
En esta
ecuación, el
potencial, V, aplicado en el
acelerador, y el campo magnético, B, son manipulables, y también se conoce la carga de
los
iones (igual a la de los electrones arrancados a cada
átomo en la
cámara de ionización). El lugar de la placa
de detección donde inciden aporta experimentalmente el
radio, único dato que falta para obtener su masa.
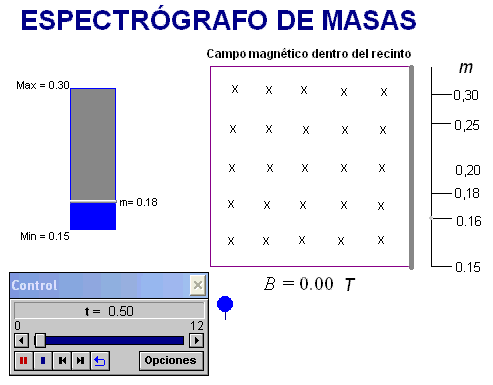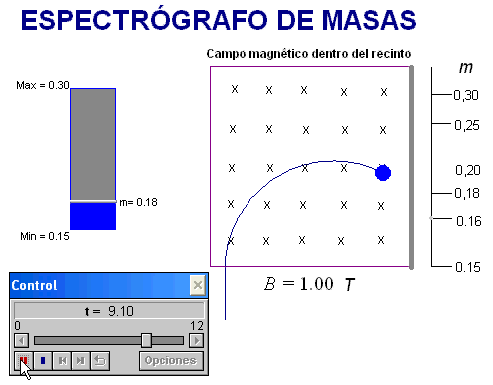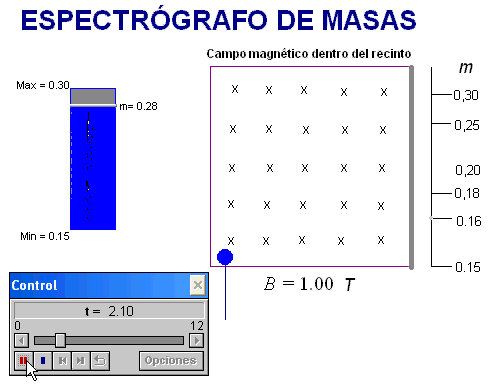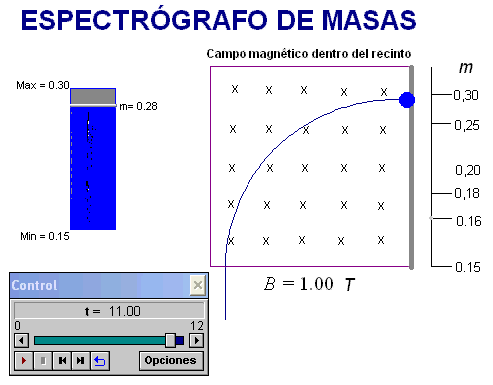
La animación
adjunta simula el comportamiento de iones en una zona
semejante a la zona de detección del espectrógrafo, por
tanto, afectada por un campo magnético
perpendicular al movimiento de los iones.
Permite elegir el valor
de la masa del ión (en unidades arbitrarias) para
así comprobar que la fuerza que le ejerce el campo
magnético le lleva a incidir sobre la pantalla de
detección en el lugar que corresponde.
Clic aquí
para descargar esta animación. Para usarla en tu
ordenador, descarga
Modellus |
|
|
|
|