| |
|
 |
COLORES
ESPECTRALES DE GASES ATÓMICOS |
 |
|
|
|
|
|
|
En
este apartado
del tema sobre Estructura del átomo
se explica que en el
siglo XIX se desarrolló el espectroscopio y se utilizó
para analizar luz generada en laboratorio por
calentamiento de diversas fuentes: gases, metales,
sales, etc. Aquellos estudios pusieron de manifiesto por
primera vez que cada átomo
produce un espectro de emisión característico y
discontinuo. |
|
|
|
|
| |
|
Sea con
un electroscopio de elaboración propia, como alguno de
los anteriores, o con los que se puedan tener en la
dotación del laboratorio, los estudiantes pueden
observar muy fácilmente espectros producidos por algunos
gases a baja presión cuando se les somete a descargas
eléctricas y comprobar de manera inmediata que la parte
visible de tales espectros producidos por esos gases
atómicos en los procesos de desexcitación que ocurren
entonces, tiene unas determinadas líneas coloreadas,
únicas e invariables para cada gas. |
|
| |
|
|
| |
|
Estudiando espectros como el anterior se constata la
cuantificación de los niveles energéticos de la materia
y se pueden asignar los colores de las líneas
espectrales observadas a las frecuencias (y longitudes
de onda) que les corresponden. Recordemos que las emisiones que provocan
la obtención de esas líneas se producen porque el gas
está siendo excitado (en este caso mediante la
aplicación de descargas eléctricas).
|
| |
|
Con más detalle,
la observación y el análisis de espectros de gases atómicos puede servir para: a) Predecir líneas
espectrales de un gas, conocidos los valores de sus niveles
energéticos. b) Interpretar el hecho de que las líneas
espectrales son siempre las mismas, independientemente de la
intensidad de la descarga eléctrica (mientras esa intensidad de
la descarga sí influye sobre la intensidad de la luz emitida) c)
Relacionar el espesor de las líneas con el principio de
incertidumbre (si no, las líneas tendrían que ser totalmente
finas, independientemente de su intensidad). |
|
|
|
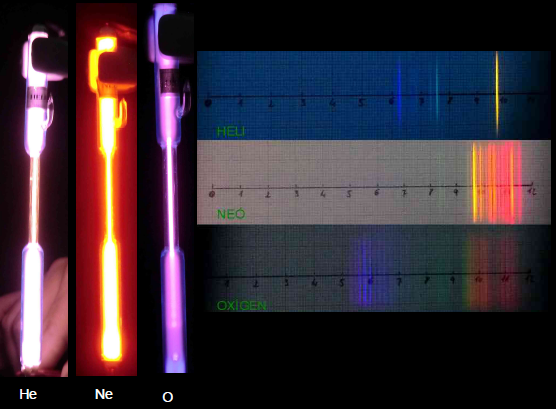
Conviene
tener presente al hacer estos análisis que la materia tiene
generalmente una estructura más simple cuando se trata
de elementos y en estado gaseoso. Por eso, los espectros
atómicos de los gases son los más sencillos y revelan un
número limitado de niveles de energía. Es el caso del
espectro del Helio gaseoso, que, como vemos en la
fotografía adjunta se asemeja al anteriormente mostrado
de Hidrógeno gaseoso en el hecho de que ambos tienen
sólo unas pocas líneas bastante separadas entre sí.
Hidrógeno y helio son los dos elementos de la tabla
periódica de menor número atómico, Z, de modo que tienen
pocos niveles energéticos, que dan lugar a pocas
transiciones electrónicas.
A partir
de aquí, al ir
aumentando el número atómico, Z, se va multiplicando el número
de niveles, lo que tiene la consecuencia de dar lugar a
unos espectros cada vez con más rayas y que pueden estar
cada vez más juntas. Obsérvense, a modo de ejemplo de
esto (en la misma fotografía) los espectros de oxígeno
gaseoso (Z=8) y de neón gaseoso (Z=10). ). También son
discontinuos, pero con un aumento notable de la cantidad
de líneas espectrales, lo que les provoca estar mucho
más juntas. |
|
 |
|
|
|
|
Ordinariamente
la materia presenta estructuras mucho más complejas
y, por otro lado, las formas de excitarla
pueden ser muy variadas (por ejemplo, térmica, eléctrica, química,
óptica,..). Todo ello
abre un amplísimo campo para un estudio de muy variadas formas
de producir colores. |
|
| |
Índice |
 |
|
|
|
|
|
|
|