|
|||||
|
Mientras se desarrollaba la Teoría atómico-molecular de la materia se fue conociendo un conjunto de hechos que ponen en cuestión una de sus principales hipótesis: la supuesta inmutabilidad e indivisibilidad de los átomos. Algunos de estos hechos son: 1) El comportamiento eléctrico de la materia, que mostró la posibilidad de extraer electrones de muchas sustancias diferentes. 2) El descubrimiento de la radioactividad, que mostró la emisión por parte de algunos minerales de radiaciones formadas por partículas subatómicas. 3) El enlace químico, que también sugería algún tipo de estructura interna de los átomos para justificar la formación de moléculas. |
|||||
| Entre todos estos hechos, el descubrimiento del electrón fue el que tuvo mayor relevancia en el cuestionamiento inicial del átomo indivisible. | |||||
|
La existencia del electrón había sido postulada inicialmente por Stoney (1826-1911) como una unidad de carga en el campo de la electroquímica. Stoney estudiaba la estructura de la materia y realizó una primera evaluación del número de Avogadro. Estas investigaciones le condujeron a establecer la hipótesis de que la electricidad era creada por unos corpúsculos elementales a los que llamó inicialmente "electrinos" (en 1874) y, más adelante (en 1891), electrones. |
|||||
|
|||||
|
Sobre este fenómeno se planteó una discrepancia entre las dos principales escuelas científicas: Por un lado los físicos británicos y franceses consideraban que los rayos catódicos eran un flujo de partículas electrificadas. En cambio, la escuela alemana planteaba que los rayos se producían en el éter (un hipotético medio que supuestamente propagaba la luz) y diferían, tanto de la luz ordinaria, como de los rayos X. |
|||||
| Intentando resolver esta discrepancia, Thomson realizó de forma consecutiva varios experimentos: | |||||
|
|||||
|
Finalmente, Thomson determinó la relación entre la carga y la masa de los rayos catódicos comprobando que era independiente de las condiciones en las que se produjeran los rayos y de la naturaleza del gas encerrado en el tubo. Comprobó que el valor de dicha relación era más de un millar de veces superior al del ión Hidrógeno (e/m = 1,758796 × 1011 C/kg), lo que indicaba que las partículas son muy livianas y/o muy cargadas. En el tema sobre electromagnetismo se puede consultar el fundamento del experimento de Thomson, que recibió en 1906 el Premio Nobel de Física por su trabajo sobre la conducción de la electricidad a través de los gases. |
|||||
|
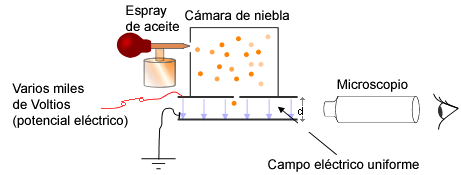
Una vez obtenida la relación carga-masa del electrón, se precisaba determinar el valor de una de estas magnitudes para conocer ambas. Tras varios intentos aproximativos de otros científicos, Millikan (1868-1953) lo logró en 1913 mediante un ingenioso experimento que se llamó de la gota de aceite. |
|||||
|
|||||
|
Millikan comprobó que los valores de las cargas q de todas las gotas eran siempre múltiplos de una carga elemental, la del electrón, e (e = 1,602·10-19 C). Conocida la carga del electrón, se deduce también inmediatamente el valor de su masa, me (me = 9,1·10-31 Kg) |
|||||
| En 1923, Millikan recibió el premio Nobel de Física por este trabajo y también por sus investigaciones sobre el efecto fotoeléctrico. |
|
Índice |