| |
|
 |
PROBLEMA
DE LA ESTABILIDAD DE LOS ELECTRONES. POSTULADOS DE BOHR |
 |
|
|
|
| |
|
Nos referimos
ahora a la tercera dificultad, la más importante, que tuvo el modelo
atómico de Rutherford: No podía
explicar la estabilidad de las órbitas electrónicas. |
| |
|
 |
|
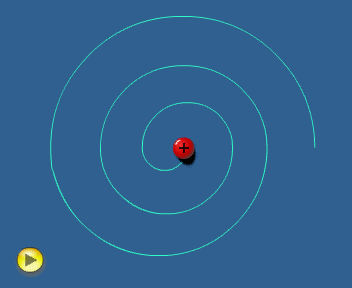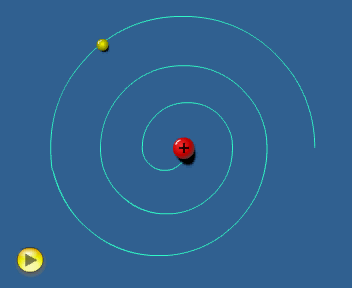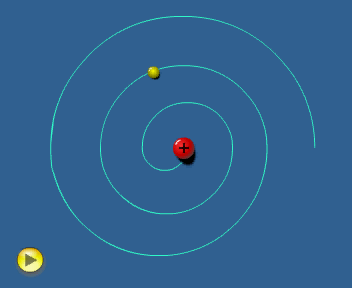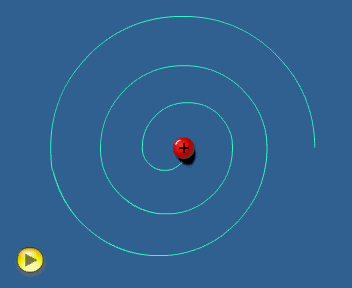
El modelo de Rutherford considera al electrón girando alrededor del
núcleo.
En estas condiciones el electrón ha de tener
aceleración (centrípeta) y, de acuerdo con la teoría electromagnética,
toda carga acelerada
emite radiación. Por tanto, el electrón debería
estar emitiendo energía ininterrumpidamente.
Esto le haría
perder velocidad, de tal forma que el electrón no podría mantener la
órbita y, tal como simula la animación adjunta, caería
finalmente sobre el núcleo. Es decir, el modelo
atómico de Rutherford es un modelo "autodestructivo",
que contradice la indudable estabilidad de los átomos.
Esta dificultad
se combina con el hecho, evidenciado por los resultados
experimentales de los espectros atómicos, de que los átomos
emiten y absorben energía de forma discreta, es decir, sólo para determinadas
cantidades que corresponden a niveles de energía que puede
tener el electrón. |
|
| |
|
A la vista de
estos hechos,
Bohr (1885-1952), trabajando en equipo con Rutherford, se
planteó el problema de la estabilidad del átomo y recurrió a una
teoría que apenas comenzaba a ser conocida sobre la naturaleza cuántica de las radiaciones.
Esta nueva teoría de la radiación iba a representar, junto con
la teoría de la relatividad, una revolución de los conceptos
físicos. Tal como se explica en el tema dedicado al
Debate histórico acerca naturaleza de
la luz, en el año 1900
Planck (1858-1947) había
formulado la
hipótesis de que la energía que puede absorber o emitir la
materia en forma de radiación electromagnética es siempre
múltiplo de una cantidad a la que llamó "quantum" o "cuanto de
energía" (posteriormente llamado fotón). En 1905 Einstein dio un paso más en la hipótesis de Planck y
planteó que los "cuantos" de energía no se han de considerar
sólo cuando un cuerpo absorbe o emite radiación
electromagnética, sino que constituyen la propia radiación (es
decir, la luz) cuando ésta se propaga. Operativamente,
la ley de Planck-Einstein dice que la energía de un "quantum" es E
= h·n,
siendo n
la frecuencia de la radiación luminosa y h una
constante universal llamada constante de Planck (h =
6,63·10-34 J·s). |
| |
|
Bohr tuvo el
acierto de aplicar esta ley al átomo de Rutherford, modificándolo
para que pudiera acomodarse a los hechos experimentales
relativos a la emisión de luz. En 1913 publicó un trabajo denominado
"Sobre la
constitución de átomos y moléculas", donde
desarrolló su propuesta para un nuevo modelo atómico. |
| |
|
 |
|
Dicha propuesta se puede derivar de los
siguientes postulados:
I.
El electrón gira alrededor del núcleo del átomo en una órbita circular.
Las órbitas electrónicas son
estacionarias y el electrón cuando se mueve en
ellas, no radia energía.
II. El impulso
angular del electrón, L [L= r x
p = r x (m· v);
para una órbita circular, es L = r·m·v ] está cuantizado, lo
que significa que de las infinitas órbitas que podría tener, sólo son
posibles las que cumplen que el impulso angular es un múltiplo
entero de h/2π (h es la constante de Plank)
III. Cuando un electrón "salta" desde
una órbita superior, de energía E2, a otra
inferior, de energía E1, la energía liberada
se emite en forma de radiación. La frecuencia (n)
de la radiación viene dada por la expresión: E2 -
E1
= hν
(h es la constante de Plank
A la
izquierda Bohr (1885 -
1952) |
|
| |
|
En las
figuras adjuntas se representan los procesos de
absorción y de emisión de radiación por el átomo de Bohr.
El electrón se encuentra en una de las órbitas
posibles (aquellas que verifican la condición impuesta
por el postulado II) sin radiar
energía (tal como exige el postulado I). Un fotón le comunicará su energía (E
= h·ν)
solo si esta energía es de un valor exactamente igual a la diferencia de energía
que hay entre dos de las órbitas posibles que puede
tener el electrón en ese átomo (postulado III). Entonces, el electrón "salta" a
otra
órbita más alejada (sin transitar entre ellas) y el
átomo queda excitado. De forma análoga un átomo puede emitir
radiación cuando alguno de sus electrones "cae"
desde una órbita alejada a una órbita más cercana al
núcleo (igualmente sin transitar entre ellas) |
|
|
|
|
Borh, N. 1913. On the Constitution of Atoms and Molecules.
Philosophical Magazine. 6, 26 |
|
|

