| |
|
 |
PROBLEMA
DE LA ESTABILIDAD NUCLEAR. DESCUBRIMIENTO DEL PROTÓN Y
DEL NEUTRÓN |
 |
|
|
|
| |
|
El modelo
atómico de Rutherford trajo un avance muy importante respecto
del primer modelo atómico que había planteado Thomson.
Pero, como aquél, encontró desde el mismo momento de ser
formulado importantes dificultades. Nos referimos aquí a una
de ellas: La dificultad para entender la estabilidad del núcleo del átomo. |
| |
|
En 1913
Moseley (1887-1915) había enunciado
una ley empírica que establece una relación sistemática entre la
longitud de onda de rayos X emitidos por distintos átomos y su
número atómico, Z. Esta ley apoya la hipótesis de la existencia de
partículas con carga positiva en el núcleo de los átomos. En
1918, un año antes de plantear su modelo, Rutherford consideró expresamente dichas
partículas. Había comprobado que al disparar las
partículas alfa contra un gas de nitrógeno, sus detectores de
centelleo muestran los mismos signos que los núcleos de
hidrógeno y dedujo que esos núcleos de hidrógeno procedían de
dentro de los núcleos del nitrógeno. Concluyó que el núcleo de
hidrógeno era una nueva partícula fundamental con
carga positiva: el protón. Sin embargo, al plantear el
modelo nuclear, vio que este hallazgo traía una dificultad: Puesto que
la carga positiva del núcleo del átomo es igual a
la carga negativa total de los electrones de dicho átomo, el
núcleo contiene varios protones (tantos como
electrones tiene el átomo). Al estar cargados
positivamente, ¿Por qué se mantienen fuertemente unidos
dentro del núcleo?. |
| |
|
 |
|
Para
resolver este problema Rutherford supuso que en el
núcleo atómico, además de los protones, debía haber
otras partículas sin carga eléctrica.
Planteó esta idea
en una conferencia ante la Royal Society (1920) y
añadió que si se encontrara esa partícula neutra sería
mucho más útil como proyectil que las partículas alfa.
Los protones y las
partículas neutras debían ejercerse fuerzas atractivas
de una nueva naturaleza y de gran intensidad para
explicar la estabilidad del núcleo a pesar de la
repulsión eléctrica entre los protones.Esta
hipótesis es compatible con el hecho de que la masa del átomo de
hidrógeno es muy aproximadamente la suma de las masas del
electrón y el protón. Sin embargo, la masa de todos los demás
átomos es mayor que la suma de las masas de sus protones más sus
electrones.
En 1932,
Chadwick (1891-1924), que había sido alumno
de Rutherford, encontró experimentalmente la nueva partícula
neutra a la que se le llamó neutrón. Como premio por este
descubrimiento se le otorgó la Medalla Hughes de la Royal
Society en 1932 y el Premio Nobel de Física en 1935. |
|
|
|
|
El descubrimiento del protón y del
neutrón, trajeron un gran avance a la interpretación del
comportamiento eléctrico de la materia. Con estos
conceptos en la mano, el modelo de Rutherford da una
base a la ordenación de los elementos en el
sistema
periódico. Los elementos se definen en función de la
carga nuclear del átomo, igual al número atómico, Z, y
se disponen en el sistema periódico en orden creciente
de dicho número. |
|
|
 |
|
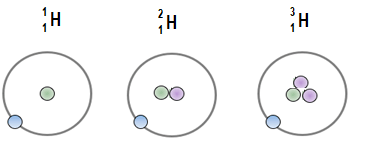
Interpretación de los tres isótopos del
Hidrógeno (Z = 1) con el modelo de
Rutherford. |
|
|
El modelo también interpreta el concepto de
isótopo, es decir, el hecho de que en bastantes
casos existen diferentes variedades alotrópicas
del mismo elemento, definidas por tener el mismo
número atómico (por tanto, un determinado número
de protones en el núcleo y los mismos electrones
alrededor de él) pero diferente número de
neutrones en el núcleo.
Así, por ejemplo, del
Hidrógeno (de número atómico 1) existen tres
isótopos, cuyos núcleos tienen
respectivamente 1 protón (Hidrógeno), un protón
más un neutrón (Deuterio), y un protón más dos
neutrones (Tritio). El número atómico de todos
ellos es Z = 1, pero la masa atómica es
respectivamente 1, 2 y 3. La proporción de
Deuterio y Tritio existente es muy inferior a la
de Hidrógeno, por lo que la masa atómica
relativa del elemento Hidrógeno es 1,007 9. |
|
|
|
|

