|
 |
COMBINACIONES ENTRE GASES. HIPÓTESIS DE AVOGADRO |
 |
|
|
|
| |
|
En el tema
dedicado al modelo cinético-corpuscular de la materia nos hemos
referido a los
trabajos de Gay Lussac sobre la variación de los volúmenes
gaseosos con la temperatura. Gay Lussac prosiguió sus
investigaciones acerca del comportamiento de los gases
estudiando los volúmenes de los gases que intervienen en las
reacciones químicas. Observó que los volúmenes de los gases,
tanto reactivos como productos, estaban entre sí en una relación
muy sencilla, si la condiciones de presión y temperatura eran la
mismas. Así por ejemplo: |
| |
| |
|
En la síntesis del
agua |
|
|
|
|
|
|
|
 |
 |
 |
 |
 |
|
2 volúmenes |
|
1 volumen |
|
2 volúmenes |
|
de hidrógeno |
|
de oxígeno |
|
de agua |
|
|
|
En la síntesis del
cloruro de hidrógeno |
|
|
|
|
|
|
|
 |
 |
 |
 |
 |
|
1 volumen |
|
1 volumen |
|
2 volúmenes |
|
de hidrógeno |
|
de cloro |
|
de cloruro de
hidrógeno |
|
|
|
| |
|
En todos los
casos, los resultados experimentales indicaban que al
reaccionar los gases en las mismas condiciones de presión y
temperatura, se combinan siguiendo relaciones volumétricas muy
sencillas, enunciado que se conoce como ley de las
relaciones volumétricas. Teniendo en cuenta esta ley, el
científico italiano
Avogadro (1776-1856) formuló en
1811 la
siguiente hipótesis: Volúmenes iguales de cualquier gas, en
las mismas condiciones de presión y temperatura, contienen el
mismo número de moléculas. |
|
|
|
 |
|
|
Con la formulación de esta hipótesis, Avogadro
(imagen de él a la izquierda de este texto)
abrió el camino a una interpretación de las
reacciones adecuada para atribuir una fórmula
química correcta a las sustancias y también a la
obtención de masas atómicas y moleculares de las
sustancias. |
| |
|
En el tema dedicado al modelo
cinético-corpuscular de la materia hemos visto
la
ley de los gases ideales, que expresa la
siguiente relación entre las cuatro variables macroscópicas
termodinámicas que determinan el estado del gas: |
|
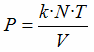 |
|
|
|
|
|
De esta
relación, que se conoció con posterioridad, se deriva
directamente la hipótesis de Avogadro, puesto que al fijar la
presión, P, y la temperatura, T, se obtiene
una misma relación para todos los gases entre el número de
moléculas, N, y el volumen, V. |
|
|
|
Una de las
consecuencias que se derivan de combinar los
resultados experimentales obtenidos por Gay Lussac con la
hipótesis de Avogadro, es la necesidad de concebir que los
átomos de un mismo elemento puedan unirse entre sí. Lo podemos
comprobar al interpretar las reacciones (de
síntesis del agua y de síntesis del cloruro de hidrógeno) a las
que nos hemos referido un poco más arriba. Teniendo en cuenta
que la relación entre el número de moléculas de las sustancias
coincide con las que hay entre sus volúmenes (medidos a la misma
presión y temperatura), se deduce que las moléculas del
hidrogeno gaseoso, el oxígeno gaseoso y el cloro gaseoso tienen
que ser di-atómicas |
|
|
| |
|
Síntesis
del agua |
|
|
|
|
|
|
|
|
|
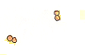 |
 |
 |
|
 |
|
 |
|
2
vol. de hidrógeno |
|
1
vol. de oxígeno |
|
|
|
2
vol. de agua |
|
|
|
|
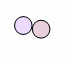
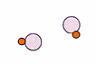
Síntesis
del cloruro de hidrógeno |
|
|
|
|
|
|
|
|
|
 |
 |
 |
|
 |
|
 |
|
1
vol. de hidrógeno |
|
1
vol. de cloro |
|
|
|
2
vol. cloruro de hidrógeno |
|
|
|
|
|
|
|
Este hallazgo
obligó a replantear el concepto de elemento, que hoy se entiende
constituido por átomos de un mismo tipo y no siempre lo hace con
la misma fórmula química. Por ejemplo, el oxígeno se puede
encontrar en la atmósfera en forma de O2 (oxígeno) y
también de O3 (ozono). Ambas sustancias son
diferentes desde un punto de vista químico, pero ambas son dos
variedades alotrópicas (alotropía significa otra manera)
del mismo elemento, oxígeno. |
|
| |
Índice |
 |
|
|
|