| |
|
 |
DESARROLLO DE LA TEORÍA
ATÓMICO-MOLECULAR |
 |
|
|
|
| |
|
Prescindiendo de
la regla de máxima simplicidad, la Teoría atómico-molecular de
Dalton puede interpretar de forma solvente un gran número de hechos
referidos a la estructura de la materia, la estructura de las
sustancias y las reacciones químicas. |
| |
|
En primer lugar,
la existencia de un número reducido de elementos indica que hay
un número limitado de átomos diferentes y una limitada
posibilidad de formar sustancias simples distintas a partir de
un solo tipo de átomos (actualmente se conocen 118 átomos
diferentes, pero poco más de 50 existen en la Tierra en
cantidades apreciables). |
| |
|
 |
|
 |
|
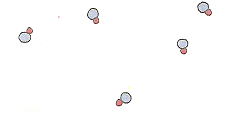
Sin
embargo, son ilimitadas las posibilidades de combinación
de los 118 átomos distintos formando moléculas
diferentes. [por ejemplo, con sólo dos átomos, A y B, se
podrían plantear los compuestos AB (representado en el
dibujo más a la izquierda), AB2 (representado
en el otro dibujo), A2B, A2B2,
AB3, etc.] Con el conocimiento químico con
que se cuenta hasta ahora, poco se puede adelantar sobre
la viabilidad de algunas de estas combinaciones. |
|
| |
|
 |
 |
 |
|
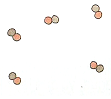
Elemento diatómico |
Compuesto diatómico |
Disolución (2 elementos) |
|
|
Otro
aspecto que se visualiza con mucha claridad mediante
dibujos inspirados en la Teoría atómica de Dalton es el
de las formas como se presenta estructurada la materia.
En general, los materiales se encuentran mezclados y no
formando sustancias puras completamente aisladas. Tal
como muestran los dibujos adjuntos, las representaciones
de porciones de gas inspiradas en el la teoría de Dalton
ayudan a
aclarar conceptualmente la diferencia entre una sustancia pura (puede
ser un elemento o un compuesto) y una disolución formada
por varias sustancias. |
|
|
|
|
Estos conceptos
son coherentes con el hecho de que los componentes de una mezcla o una disolución (mezcla
homogénea) se han de poder separar mediante procedimientos
físicos (como, por ejemplo, una destilación, una filtración,
etc.). Sin embargo, para obtener sustancias puras simples
(elementos) a partir de otras sustancias puras "complejas"
(compuestos) se requiere una reacción química (llamada, en este
caso, análisis). En dicha reacción se han de separar los átomos
que componen las moléculas de los elementos (si no son
monoatómicos) y luego formarse las moléculas del compuesto.
|
|
|
|
|
|
|
|
 |
|
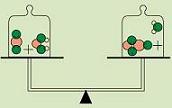
Estos desarrollos
también apoyan las leyes ponderales
de las reacciones químicas. Es evidente que, puesto que
las moléculas de un compuesto están formadas por un
número fijo de átomos de cada uno de los elementos en
los que se puede descomponer, se tiene que verificar la
ley de las proporciones simples y también la ley de las
proporciones múltiples. También es evidente que se ha de
cumplir el principio de conservación de la masa, ya que,
según ilustra el dibujo adjunto, los átomos de las
sustancias iniciales que intervienen en una reacción
(reactivos) son los mismos (reagrupados de otro modo) de
las sustancias finales (productos). |
|
|
| |
Índice |
 |
|
|
|
|
|