| |
|
 |
COLORES
PIGMENTO (MOLÉCULAS INORGÁNICAS) Y MATERIALES INORGÁNICOS |
 |
|
|
|
| |
|
Además
de los pigmentos de materia orgánica, en
el medio natural existe una gran cantidad y variedad de
pigmentos de materia inorgánica. Considerando cuál es la sustancia química
que tiene la capacidad de absorber y reflejar
selectivamente luz y cuál o cuáles son las tonalidades
de luz que refleja, podemos mencionar algunos,
como:
arsénico (color verde de París),
carbono (negro de carbón,
negro marfil,
negro viña,
negro de humo), cadmio
(verde de cadmio,
rojo de cadmio,
amarillo de cadmio,
naranja de cadmio),
óxidos de hierro (rojo óxido,
ocre,
ocre rojo,
rojo veneciano), cromo
(verde de cromo y
amarillo de cromo),
cobalto (azul cobalto,
azul cerúleo,
violeta de cobalto,
amarillo de cobalto),
plomo (blanco de plomo,
amarillo de Nápoles,
rojo de plomo), cobre (verde
de París, verdi gris,
azul egipcio),
titanio (blanco de titanio,
amarillo de titanio,
negro de titanio),
mercurio (bermellón),
zinc (blanco de cinc), arcilla (siena
natural, sombra
natural, sombra
tostada, ocre). |
|
|
|
Los
procesos que, a nivel microscópico, pueden dar lugar a
la coloración de materiales formados por sustancias
inorgánicas pueden ser bastante diversos. Uno de los más
frecuentes es que fotones de la luz incidente
interaccionen con electrones que existen entre los
átomos o iones del material. |
|
|
|
 |
|
Si se trata de un material metálico, dichos
átomos presentan una estructura reticular y la
interacción luz-materia provoca globalmente
saltos hacia estados de energía más excitados de
la red. Como dicha red se conforma con una cantidad enorme de
átomos, sus niveles de energía se agrupan casi
siempre en
bandas (el número de orbitales de
valencia es tan grande y la diferencia de
energía entre cada uno de ellos tan pequeña que
se puede considerar que los niveles de energía forman esas bandas continuas en
vez de niveles de energía separados). En el caso
de materiales semiconductores o aislantes (como,
por ejemplo, vidrio, silicio,
óxidos, nitruros, y, más en general, casi todos
los minerales), teniendo en cuenta que
algunos intervalos de energía no contienen
orbitales, quedan "gaps" energéticos
o bandas prohibidas entre diferentes bandas
de energía permitidas. En cambio, en la mayoría de
metales puros las bandas se superponen y lo más habitual es que
pueda haber reflexión en
todas las longitudes de onda.
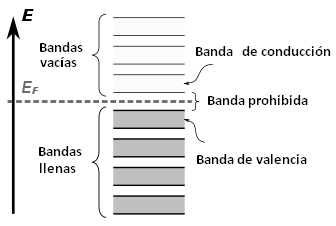
La figura adjunta
esquematiza una distribución típica de bandas de
un semiconductor. La de un metal puro sería
bastante similar, pero con unas bandas de
conducción semillenas en lugar de la banda
prohibida que define a los semiconductores y
aislantes. |
|
|
|
|
A partir de aquí, el color y el brillo de algunos metales puros y
conductores, como el oro, la pirita, la plata,
el cobre, etc. se debe justamente a transiciones
de electrones entre bandas, cuyas energías, como
acabamos de decir, se
superponen.
También en varios minerales,
formados mayormente por materiales
semiconductores o aislantes, lo que domina la
producción de color son
impurezas de metales puros (pequeñas cantidades de estos metales
que impregnan al mineral). Por
ejemplo, el color azul
del zafiro (imagen adjunta, arriba a la izquierda) se debe a transiciones de electrones
entre impurezas de titanio y de hierro, el color rojo
del rubí (imagen adjunta, arriba a la derecha.),
se debe a impurezas de cromo, el color
verde azulado de la esmeralda
(imagen adjunta, debajo) se debe a
impurezas de cromo
y, en ocasiones, de vanadio, etc. Este
mismo proceso de transiciones electrónicas da
lugar también, por ejemplo, al color azul al lapislázuli,
el color
verde a la
amazonita, el negro-grisáceo a la magnetita,
etc. |
|
|
|
|
|
|
 |
|
En
cambio, hay otros muchos minerales, provistos
generalmente de metales semiconductores, cuyos colores se deben a
transiciones entre bandas separadas (ya que,
como hemos dicho, un semiconductor se caracteriza precisamente
por la existencia de "gaps" energéticos entre
las bandas de energía permitidas). Un ejemplo de
ello es el color rojo intenso del sulfuro de mercurio,
que impregna al cinabrio, también llamado
bermellón debido a que,
como puede verse en la fotografía adjunta, muestra de manera
exuberante esta tonalidad |
|
|
|
|
Aunque
hemos dicho que las estructuras atómico-moleculares de
la mayoría de materiales inorgánicos con estructura
cristalina da lugar a bandas de energía, también existen
algunos que, teniendo esa misma estructura
cristalina, muestran estados energéticos estacionarios que
recuerdan en gran medida a los estados energéticos de
los átomos. Ocurre así con bastantes de las llamadas
piedras preciosas. |
|
|
|
 |
|
Además de la transferencia de cargas, entre las
moléculas inorgánicas del medio natural también
hay bastantes, cuyos estados de energía más o
menos excitados a los que pueden saltar cuando
son iluminadas, se corresponden con estados vibracionales y/o rotacionales diferentes de
esas moléculas. Los estados de
vibración y/o de rotación de los enlaces entre
los átomos que forman tales moléculas están cuantizados, de modo que siempre que hay un
cambio entre dos niveles de energía, se
absorbe/emite radiación; da igual que estos
niveles sean atómicos, moleculares o de una red
de moléculas. En general los saltos entre
estados vibracionales o rotacionales dan lugar a
emisión de luz que no son visibles al ojo
humano, con algunas excepciones. Una de ellas,
es el hielo glacial que genera de este modo su
espectacular color azul. |
|
|
|
|
|
Terminamos este apartado, recordando la gran
cantidad de pigmentos, tanto de origen orgánico como
inorgánico, utilizados por el ser humano y su papel en
el desarrollo de la humanidad.
Desde los óxidos de hierro presentes
en las pinturas rupestres (el
ocre rojo,
seguramente fue el primer pigmento que se usó
deliberadamente con fines artísticos), hasta los
pigmentos sintéticos actuales, que son utilizados para
teñir pintura, tinta, plástico, textiles,
cosméticos, alimentos y otros muchos productos. |
|
 |
|
 |
|
|
| |
Índice |
 |
|
|
|
|
|
|
|