| |
|
 |
COMPORTAMIENTO FÍSICO DE LOS GASES Y MODELO CINÉTICO-CORPUSCULAR |
 |
|
|
|
| |
|
La polémica
entre continuidad y discontinuidad de la materia, que había
enfrentado en
la antigua Grecia a atomistas con anti-atomistas, prosiguió en un
terreno más o menos especulativo hasta principios del XIX.
Entonces se había acumulado un conjunto de conocimientos
que permitió elaborar un modelo de estructura
de la materia basado en leyes sobre sus transformaciones
físicas y químicas. Por lo que se refiere a las primeras,
resultaron de gran ayuda los estudios sobre el comportamiento
físico de los gases, debido a que en el estado gaseoso las
sustancias presentan el comportamiento más simple. |
|
|
|
Enumeramos de
forma resumida propiedades definitorias de la materia en estado gaseoso: |
| |
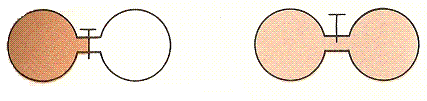 |
|
 Difusibilidad: Los
gases ocupan todo el recipiente donde se hallan y se
mezclan muy fácilmente. Podemos comprobarlo, por
ejemplo, encerrando un gas en uno de los dos
compartimentos del dispositivo que muestra la figura adjunta
(a la izquierda). Al cabo de poco tiempo de abrir la
llave de paso todo el gas se distribuye de forma uniforme por
todo el recipiente y ocupa completamente los dos
compartimentos.
Difusibilidad: Los
gases ocupan todo el recipiente donde se hallan y se
mezclan muy fácilmente. Podemos comprobarlo, por
ejemplo, encerrando un gas en uno de los dos
compartimentos del dispositivo que muestra la figura adjunta
(a la izquierda). Al cabo de poco tiempo de abrir la
llave de paso todo el gas se distribuye de forma uniforme por
todo el recipiente y ocupa completamente los dos
compartimentos. |
|
| |
|
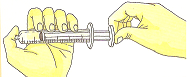
 Compresibilidad:
Los gases se pueden comprimir con bastante facilidad. Podemos comprobarlo, por
ejemplo, encerrando aire en una jeringuilla y
presionando el émbolo para comprimirlo.
Compresibilidad:
Los gases se pueden comprimir con bastante facilidad. Podemos comprobarlo, por
ejemplo, encerrando aire en una jeringuilla y
presionando el émbolo para comprimirlo. |
|
 |
|
|
|
|
 |
|
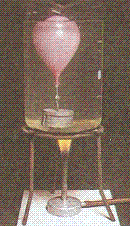 |
|
 Presión:
Los gases ejercen fuerzas sobre las paredes del
recipiente que los contiene. En el experimento de la
jeringuilla notamos muy claramente la fuerza que ejerce
el aire encerrado sobre nuestra mano y también
observamos que al soltar el émbolo vuelve a su posición
inicial, empujado por el aire encerrado.
Presión:
Los gases ejercen fuerzas sobre las paredes del
recipiente que los contiene. En el experimento de la
jeringuilla notamos muy claramente la fuerza que ejerce
el aire encerrado sobre nuestra mano y también
observamos que al soltar el émbolo vuelve a su posición
inicial, empujado por el aire encerrado.
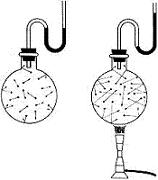
 Aumento de la presión
con la temperatura y dilatación térmica:
Al aumentar la temperatura de un gas (al calentarlo)
aumenta la presión que ejerce sobre las paredes del
recipiente. Si dichas paredes son
elásticas (como ocurre, por ejemplo, para el aire
encerrado en el globo del experimento que muestran las
fotografías adjuntas a la izquierda), aumenta el volumen.
Aumento de la presión
con la temperatura y dilatación térmica:
Al aumentar la temperatura de un gas (al calentarlo)
aumenta la presión que ejerce sobre las paredes del
recipiente. Si dichas paredes son
elásticas (como ocurre, por ejemplo, para el aire
encerrado en el globo del experimento que muestran las
fotografías adjuntas a la izquierda), aumenta el volumen. |
|
|
|
|
Descritas
estas propiedades de la materia en estado gaseoso, estamos en
situación de buscar un modelo que sea capaz de explicarlas
todas. |
|
|
 |
|
|
|
El fenómeno de la difusión sugiere
que los gases estén formados por partículas en
movimiento (si no, ¿qué es lo que hace que, por ejemplo,
el olor viaje?). Al mismo tiempo, el hecho de que los
gases no se vean y se mezclen con tanta facilidad induce
a pensar que esas partículas tienen que ser muy pequeñas
y estar bastante separadas entre sí.
Todo ello induce a
concebir a la materia en estado gaseoso mediante el modelo cinético-corpuscular de los gases,
según el cual estarían formados (a nivel sub-microscópico)
por muchas partículas (o corpúsculos) en movimiento, muy
pequeñas, y muy separadas entre sí (en comparación con
su tamaño). |
|
|
|
|
Este modelo
explica satisfactoriamente el resto de propiedades macroscópicas del comportamiento
de los gases. Así, el hecho de que los
gases ejerzan fuerza sobre las paredes se explica considerando
que sus partículas, al estar en movimiento, chocan con dichas
paredes. La presión es, pues, una magnitud macroscópica
indicadora del número de choques
que se producen (por unidad de tiempo y de superficie) y de la
intensidad de esos choques. |
| |
|
 |
|
Al comprimir un gas (reduciendo el volumen del
recipiente) aumenta la frecuencia de los choques de sus
partículas sobre el recipiente, y, por tanto, aumenta la
presión. El efecto contrario (disminución de la presión)
se produce al expandir el gas. |
|
| |
|
 |
|
En
cuanto a la temperatura de los gases, es otra
magnitud macroscópica que indica la energía cinética media de sus partículas
(dependiente a su vez de su masa y su velocidad) y esto explica
satisfactoriamente el comportamiento de los gases cuando se calientan
o se enfrían.
En
efecto, al calentar un gas (al aumentar su temperatura)
aumenta la energía cinética de sus partículas y, por
tanto, sus velocidades. Si el volumen permanece
constante, ello implica que las partículas lleguen antes
a chocar con las paredes del recipiente y además choquen
con mayor velocidad. Es decir, aumenta la frecuencia de
los choques y su intensidad, o, lo que es lo mismo,
aumenta la presión que ejerce el gas. Evidentemente,
ocurre lo contrario si se enfría el gas. |
|
| |
Índice |
 |
|
|
|
|
|
|