| |
|
 |
AMPLIACIÓN DEL MODELO DE BOHR. NÚMEROS
CUÁNTICOS |
 |
|
|
|
| |
|
A pesar del gran
avance logrado por el modelo de Bohr, su éxito tampoco fue muy
duradero y casi inmediatamente después de su aplicación
fue necesario revisarlo para atender a los resultados de los espectros atómicos. Los espectros de átomos poli-electrónicos
ya habían evidenciado una estructura mucho más compleja en la que,
en lugar de cada línea "gruesa" que podía corresponder a un nivel de energía del modelo de Bohr,
se encontraba un conjunto de líneas más finas. Al utilizar
espectroscopios más potentes, el espectro de Hidrógeno enseguida
mostró que sus rayas
espectrales también estaban desdobladas. |
| |
|
 |
|
En
1916
Sommerfield
(1868-1951) dio una interpretación de estos
hechos proponiendo una mayor complejidad en la
estructura electrónica que la que había considerado el
modelo inicial de Bohr: "El desdoblamiento de las líneas
espectrales se debe a que cada
nivel de energía calculado a partir de los postulados de Bohr
en realidad esta formado por varios subniveles".
Relacionó esta propuesta con la suposición de que las órbitas del electrón podían
ser elípticas y con diferentes
excentricidades. Recordemos que el modelo de Bohr
inicial utiliza
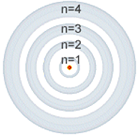
un único parámetro, n, para caracterizar los niveles de energía
permitidos del electrón. Este parámetro se llama número cuántico
principal y puede
tomar los valores: 1, 2, 3..., . Para cada uno de estos
valores, se obtiene la energía y el radio de una órbita
electrónica que se supone siempre circular. |
|
| |
|
Para
tener
en cuenta el desdoblamiento de las líneas espectrales
iniciales del átomo de Hidrógeno, Sommerfield introdujo un
segundo parámetro, l (número cuántico
secundario), que
puede tomar los valores los valores l = 0, 1, 2,…(n-1). |
|
|
|
 |
|
|
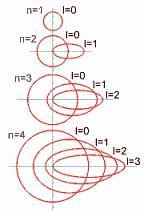
Así, para cada valor de n se permiten varias órbitas
electrónicas de diferente
excentricidad. Tal como se indica en la figura
adjunta l=0 corresponde a la órbita
circular, l=1 a la órbita elíptica menos
excéntrica, l=2 a la siguiente, de mayor
excentricidad que la anterior,.. (la
excentricidad de una elipse aumenta cuanto mayor
sea la separación entre sus dos focos; una
circunferencia es una elipse
de excentricidad nula, en la que coinciden
los dos focos en el centro de la
circunferencia). |
| |
|
Formalmente el número cuántico
secundario se liga a una
cuantización del momento cinético o cantidad de
movimiento angular del electrón en su órbita,
porque decir que el electrón sólo puede tener determinadas órbitas elípticas es lo mismo que
afirmar que su momento cinético sólo puede tener determinados valores.
Por ello, al número cuántico secundario se le denomina número cuántico del momento
angular o número cuántico azimutal. |
|
|
|
|
|
Los subniveles l = 0, 1, 2 y 3 se designan respectivamente con las
letras s, p, d y f , derivadas de la
terminología inglesa para la espectroscopía. Así, por ejemplo,
2s designa el subnivel de número cuántico principal 2 y número
cuántico secundario 0, 3p designa el subnivel de número cuántico
principal 3 y número cuántico secundario 1, etc. |
|
|
|
Otros hechos
iban a complicar aún más este modelo de Bohr-Sommerfield. En
1896, al estudiar la acción de campos magnéticos sobre los
espectros de algunos gases,
Zeeman
(1865-1943), había descubierto el efecto que lleva su nombre:
Las líneas espectrales de una fuente luminosa sometidas a un
campo magnético intenso se dividen en varios componentes, cada
uno de ellos polarizado. Este descubrimiento se
enmarcaba en una investigación dirigida por su maestro,
Lorentz (1853-1928), con el propósito de
suministrar pruebas a favor de la
teoría electromagnética de la luz. Además de contribuir a
este objetivo, el efecto descubierto enseñó otra
complejidad en la estructura del átomo. |
|
|
|
 |
|
Para dar cuenta
de dicha complejidad, se interpretó el desdoblamiento
espectral considerando que un electrón girando alrededor
de un núcleo es equivalente a una corriente eléctrica, y
como tal produce un campo magnético perpendicular al
plano en el que se mueve el electrón (es decir, es un
pequeño imán). Al aplicar un campo magnético externo al
átomo, ese imán electrónico se orienta.
Entonces, el hecho de que al aplicar el campo magnético
al átomo la línea espectral se divida en un número
determinado de ellas, indica que esa orientación de la
corriente electrónica afectada por el campo magnético
también está cuantizada, o, dicho de otro modo, indica que la
corriente electrónica
sólo puede tener determinadas orientaciones. Estas
orientaciones permitidas dependen de la dirección en la que
se aplica el campo magnético externo y de la corriente electrónica
que lo sufre, la cual a su vez
depende del momento angular del electrón y se caracteriza
por el número cuántico azimutal, l.
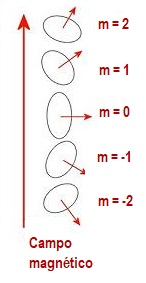
Usando estos razonamientos se introdujo un tercer
número cuántico, m (número cuántico magnético),
cuyos valores posibles dependen de l. El número
magnético m
puede tener todos los valores enteros entre -l
y +l, incluyendo el cero. Así, por ejemplo, para l=2, m puede valer -2,
-1, 0, 1, 2, lo que implica que el subnivel d
se desdobla en otros 5. La figura adjunta
representa estos 5 desdoblamientos sobre la
imagen de una corriente electrónica equivalente a un pequeño imán. |
|
|
|
En 1902 Zeeman y Lorentz, fueron galardonados
con el Premio Nobel de Física por su
investigación conjunta sobre la influencia del
magnetismo en la radiación, originando la
radiación electromagnética.
|
|
|
|
Con la introducción de los números azimutal y magnético
se
explicaban los tripletes (subnivel p) y quintupletes (subnivel
d) del efecto Zeeman. Pero, se vio que el
efecto Zeeman también presentaba otras colecciones de líneas,
que no eran explicadas con estos números y se
llamó efecto Zeeman anómalo. Se trata de dobletes que
inicialmente se observaron en el subnivel s, donde l=0 y sólo
debería haber un valor posible de m (m=0). Posteriormente se
comprobó que estos dobletes ocurren en todos los subniveles y en
1925
Uhlenbeck
(1900-1988) y
Goudsmit
(1902-1978) introdujeron un cuarto número cuántico,
s (número cuántico de espín) para explicarlos.
Este cuarto número tiene la particularidad
de no relacionarse con la órbita ocupada en el átomo y hacerlo
en cambio con una hipotética rotación del electrón sobre sí mismo
(en inglés spin significa giro o girar). |
|
|
|
 |
|
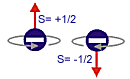
Imaginando al electrón como una partícula cargada que
gira alrededor de un eje propio, se deduce que generará
un campo magnético y se plantea que únicamente puede
tener dos sentidos de giro posibles. A estos sentidos de
giro de la hipotética rotación interna del electrón le
corresponden dos posibles valores del espín: +1/2,
-1/2, que más coloquialmente se denominan espín arriba o
espín abajo. |
|
|
|
|
Una manera más formal de
interpretar el espín es asignar al electrón un momento angular
intrínseco. Con el desarrollo de la mecánica cuántica este
concepto se extendió a todo tipo de partículas (aunque no tengan
carga eléctrica) y se pudo comprobar mediante un notable
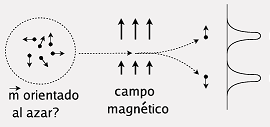
experimento realizado en 1922 por Stern y Gerlach. En dicho experimento, un haz de
átomos de plata era colimado por dos rendijas estrechas y
atravesaba una bobina magnética. |
|
|
|
 |
|
La interacción del campo magnético
producido por la bobina con el momento angular de los
átomos de plata provoca que éstos se desvíen de su
trayectoria. En principio, cada átomo podría tener
cualquier orientación de su momento angular, sufriría
una desviación distinta, y el haz se abriría de forma
continua. Sin embargo, se observó que haz inicial se
divide en dos haces perfectamente definidos, lo que
indica que el momento angular intrínseco de los átomos
sólo tiene dos orientaciones (por tanto, dos posibles
valores del espín). |
|
|
|



