| |
|
 |
DESCUBRIMIENTO DEL NÚCLEO. MODELO DE RUTHERFORD |
 |
|
|
|
| |
|
El modelo de
Thomson necesitaba ser puesto a prueba para contrastar su
validez. Pero hay que tener en cuenta que el tamaño de los
átomos es muy pequeño (por ejemplo, el diámetro estimado
del átomo de hidrógeno es del orden de 0,00000001 cm), por lo
que no resulta fácil detectar experimentalmente como están
formados. El descubrimiento de la radiactividad a finales del siglo XIX
proporcionó la posibilidad de bombardear la materia con
partículas cargadas muy rápidas y contrastar el modelo. |
| |
|
 |
|
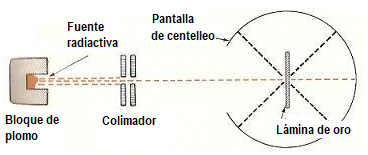
Rutherford (1871-1937)
concibió un experimento que consistía en lanzar
partículas alfa (a)
contra una finísima película de oro. La trayectoria
de las partículas se podía observar, según se ve en el
esquema de la figura adjunta, por los destellos que
producían al chocar sobre una pantalla de sulfuro de
cinc (ZnS). Aceptando el modelo de Thomson, las partículas
tendrían que sufrir desviaciones muy pequeñas.
Hay que
tener en cuenta que, según ese modelo, la masa del átomo
es fluida y está uniformemente repartida, por lo que no
debería presentar resistencia excesiva al paso de las partículas a,
que portan una gran cantidad de movimiento. |
|
| |
|
Sin embargo los
resultados fueron bastante diferentes de lo
esperado: Aunque, la mayor parte de las partículas a
se comportaban según lo previsto y atravesaban la lámina de oro
sin sufrir desviaciones aparentes, unas pocas sorprendentemente sufrían grandes desviaciones,
llegando incluso en algunos casos al retroceso. Rutherford
prestó la máxima atención a las partículas que sufrían grandes
desviaciones, llegando a la conclusión de que el átomo no podía
ser homogéneo, idea que le hizo rechazar el modelo de Thomson
y proponer el suyo. Lo contó así: |
|
|
|
 |
|
Había
observado la dispersión de partículas y el Dr. Geiger,
en mi laboratorio, la había examinado detenidamente.
Encontró que la dispersión producida por piezas de metal
delgadas era generalmente pequeña, del orden de un
grado. Un día Geiger vino y me dijo: "¿No cree usted que
el joven Marsden, a quien he preparado en los métodos
radiactivos, debía empezar una pequeña investigación?".
Yo había pensado lo mismo y le dije: "¿Por qué no le
dejamos ver si las partículas pueden sufrir una gran
dispersión con un gran ángulo?. Debo decirle en
confianza que yo no lo creo, puesto que las partículas
son muy rápidas, de gran masa y gran energía, y si la
dispersión fuera debida a la acumulación de de pequeñas
dispersiones, la probabilidad de que fuese dispersada en
el retroceso sería muy pequeña". Recuerdo que dos o tres
días después vino Geiger con una gran excitación y me
dijo: "Hemos logrado obtener el retroceso de algunas
partículas". Es lo más increíble que me ha sucedido en
mi vida, Casi tan increíble como si usted disparase una
bala de 15 pulgadas contra un papel de seda y el
proyectil se volviese contra usted. Al considerar el
fenómeno, llegué a la conclusión de que el retroceso
debía ser el resultado de una simple colisión, y al
hacer los cálculos vi que era imposible obtener aquél
orden de magnitud a no ser que se considere un sistema
en la que la mayor parte del átomo se encuentre
concentrada en un pequeño núcleo. Fue entonces cuando
tuve la idea del átomo formado por un núcleo masivo como
centro y con carga.
A la
izquierda Rutherford
(1871 - 1937) |
|
|
|
 |
|
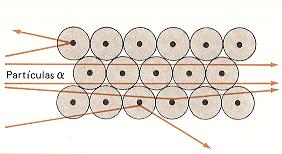
Así, Rutherford
propuso en 1919 un modelo de un átomo prácticamente
vacío, con un núcleo central en el que está concentrada
la carga positiva y la masa. Los electrones de cada
átomo (en un número igual a la carga nuclear) están
alrededor del núcleo, completando el volumen del átomo. Tal como indica el dibujo
adjunto, este modelo permite explicar los resultados del
experimento de bombardeo con partículas a,
al considerar que la desviación de las partículas se
produce únicamente por causa de los núcleos de los
átomos de la lámina de oro. No son afectadas por los
electrones porque la masa de éstos es insignificante
frente a la de los proyectiles. |
|
|
|
|
Teniendo
en cuenta que los
electrones (de carga negativa) son atraídos por el
núcleo central (de carga positiva), Rutherford planteó
también que giran
alrededor del núcleo como lo hacen los planetas
alrededor del Sol, con lo que la fuerza de atracción
electrostática dirigida hacia el núcleo da lugar a una
aceleración centrípeta. Por ello, al modelo nuclear de Rutherford
también se le llama modelo planetario. |
|
|
|
|
Dos
datos pueden ayudar a comprender la vacuidad del
átomo nuclear de Rutherford: 1) El radio del núcleo es del
orden de 10-15 m. 2) El radio del átomo
(medido desde el núcleo hasta el último electrón de dicho átomo)
es del orden de 10-10 m (ambos datos para un
átomo medio, semipesado). Esos datos dicen que si se agrandara
el núcleo del átomo hasta que fuese similar a una canica, el
tamaño del átomo sería mayor que un campo de fútbol. |
|
|
|
Para
tomar conciencia de estos órdenes de magnitud puede
ayudar la animación adjunta que va obteniendo paulatinamente
el patrón de dispersión de partículas cargadas
positivamente (podrían ser partículas a) por otra carga fija del
mismo signo (podría ser el núcleo de un átomo).
Al
comparar el patrón que se va obteniendo con el resultado del experimento
de Rutherford se comprende que los átomos dispersantes
tienen que estar prácticamente vacíos, es decir, su
núcleo tiene que ser extremadamente pequeño en
comparación con el volumen atómico.
Clic
aquí
para descargar la animación. Para usarla en tu ordenador instala
Modellus |
|
 |
|
|
|
Rutherford, E. 1911. The Scattering of α and β Particles by
Matter and the Structure of the Atom. Philosophical Magazine.
21, 669-688. |
|
Rutherford, E. 1914. The Structure of the Atom. Philosophical
Magazine. 27, 488-498 |
|
|


