|
|
|
 |
|
CALENTAMIENTO Y CAMBIO DE ESTADO DE UNA MASA DE AGUA |
|
|
|
Experimento realizados por
alumnos de 3º ESO en el IES "Leonardo da Vinci" de Alicante.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PLANTEAMIENTO, HIPÓTESIS Y DISEÑO EXPERIMENTAL |
| |
| |
|
 |
|
Se desea estudiar
la evolución de la temperatura de una
masa de agua a lo largo de un proceso de
calentamiento. A modo de hipótesis, los
estudiantes esperan que, si se aporta al
agua un flujo de calor uniforme, la
temperatura aumentará a
un ritmo también uniforme, de modo que la
relación entre la temperatura que va
adquiriendo el agua y el
tiempo transcurrido sea lineal. Si los
alumnos han estudiado antes en clase los
cambios de estado, también prevén que
la temperatura del agua se estabilice al
alcanzar 100 ºC.
Al alcanzarse dicha temperatura debería
empezar
la ebullición del agua, durante la cual
la energía aportada se emplea completamente en
producir el cambio de estado, sin
aumento de temperatura.
Un diseño
experimental sencillo puede utilizar un vaso de
precipitado conteniendo el agua a
calentar y una resistencia sumergible
que aportará la energía. Para realizar
las mediciones los estudiantes pueden
sumergir en el agua un sensor de
temperatura o, alternativamente,
pueden sumergir un termómetro
tradicional y usar un cronómetro para
medir el tiempo.
|
|
| |
|
|
|
|
| |
|
 |
| |
|
DESARROLLO DEL EXPERIMENTO. EVAPORACIÓN Y
EBULLICIÓN |
| |
|
|
| |
|
 |
|
En el experimento que aquí se
expone, realizado por estudiantes de 3º ESO, los
alumnos se repartieron en
equipos de 2-3 alumnos. Tomaron
lecturas de la temperatura cada minuto cuando
usaron un termómetro de mercurio para medir la temperatura.
Cuando usaron el sensor de temperatura, lo configuraron
con una velocidad de muestreo de 5 s.
Además de construir la
gráfica de la evolución de la temperatura los estudiantes
debían describir fenómenos que se pueden observar en la masa de agua
durante el proceso (como ascensos de burbujas de
aire, corrientes de convección, evaporación del
agua y la misma ebullición) |
|
|
|
|
Nos detenemos a comentar brevemente los procesos de evaporación
y de ebullición. |
|
|
|
|
|
|
|
La evaporación es un proceso
paulatino que se produce durante todo el
experimento y va
adquiriendo mayor intensidad a medida que
aumenta la temperatura del agua.
Técnicamente consiste en un
paso gradual del estado líquido hacia el estado
gaseoso, por parte de una parte de las moléculas
del agua, que tienen energía suficiente para
vencer la
tensión superficial o, dicho de otro modo,
para romper los enlaces intermoleculares.
La ebullición, en cambio,
sólo
se produce cuando la temperatura de la
totalidad del líquido alcanza un valor
determinado o punto de ebullición del líquido a
esa presión.
Formalmente se define como la
temperatura a la cual la presión de vapor del
líquido iguala a la presión de vapor del medio
en el que se encuentra. A partir de que dicha
temperatura se alcanza, la energía que aporta al
líquido la resistencia se invierte totalmente en producir el
cambio de estado, sin que vuelva a aumentar la temperatura
hasta que toda la masa del agua haya pasado al estado
gaseoso.
Cuando se está produciendo la
ebullición, todo el líquido se agita,
observándose en él abundantes "borbotones".
|
|
Evaporación
(video a la izquierda) y ebullición (video a la
derecha) |
|
|
|
|
|
|
|
| |
|
 |
| |
|
GRÁFICA DE LA TEMPERATURA FRENTE AL TIEMPO |
| |
|
|
|
 |
|
 |
|
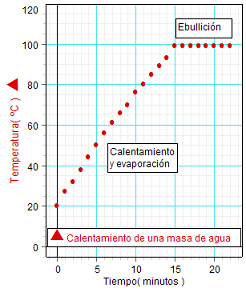
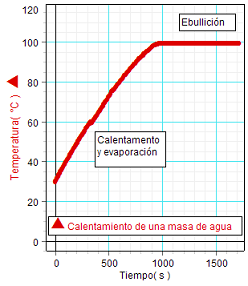
Las gráficas adjuntas recogen resultados de la evolución de
la temperatura con el tiempo obtenidos por dos
equipos de alumnos.
Uno de dichos equipos utilizó
un termómetro de mercurio y un cronómetro, e
hizo lecturas de la temperatura a
intervalos de un minuto (gráfica de la
izquierda).
El otro equipo usó directamente
en el experimento el sensor de
temperatura (gráfica de la derecha). Ambos utilizaron el
programa DataStudio para representar y analizar la gráfica.
Como se ve,
ambas gráficas coinciden bastante bien con las
hipótesis, mostrando que en el proceso de
calentamiento la temperatura aumenta
progresivamente y la relación entre
temperatura y tiempo no se aleja mucho
de una relación lineal, hasta que, al
alcanzar un valor
próximo a 100 ºC, comienza la
ebullición (desde entonces, la
temperatura se mantiene constante). |
|
| |
|
|
|
|
| |
|
 |
|
|
|
TEMPERATURA DE EBULLICIÓN |
| |
|
|
| |
 |
|
 |
|
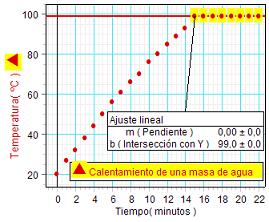
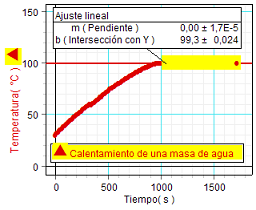
Algo que conviene aprovechar es el
hecho de que la temperatura experimental del punto de
ebullición del agua generalmente no coincide con el
valor 100 ºC.
Como puede verse en los análisis que se
muestran adjuntos, en nuestro caso se obtuvo en todos
los ensayos una temperatura inferior (del orden de 99 ºC).
Como los estudiantes no lo esperan,
les pedimos que realicen un estudio "bibliográfico"
(puede ser vía Internet) acerca del significado del
punto de ebullición y los factores que pueden influir en
su valor. |
|
|
| |
|
|
| |
|
Realizado y tras la puesta en común, podemos
explicar mejor a la clase que, puesto que la
ebullición se produce cuando la totalidad de las
moléculas del líquido pueden "separarse", no
sólo cuenta que cada parte del líquido tenga una
determinada cantidad de energía interna (o su
equivalente temperatura), sino que influyen
posibles factores en contra del proceso (sobre
todo la presión exterior, que además puede
depender de la presión del propio vapor que se
va produciendo, pero también la posible
existencia de otras sustancias que contribuyan
aumentar la ligazón entre las moléculas del
líquido, otras que floten sobre él, etc.) y/o a
favor (principalmente una presión exterior
inferior, pero también la presencia de otras
sustancias disueltas que favorezcan la
separación de las moléculas de agua) |
|
|
|
|
Por todo ello, el punto de ebullición
se define para cada sustancia (en este caso tendría que
ser agua pura) y supuesto un determinado valor de la
presión exterior (en este caso 1 atmósfera, o presión
atmosférica estándar a nivel del mar). En el experimento
realizado es evidente que no se dan estas condiciones y
que el conjunto de factores dio un balance favorable al
proceso, permitiendo la ebullición a una temperatura
ligeramente inferior a 100 ºC. |
|
|
|
|
|
|
|
|
 |
|
|
|
ARCHIVOS DE DATASTUDIO: Puedes descargar los
resultados originales
del experimento que
se describe en esta página. Para abrirlo se necesita el programa "DataStudio", del que tienen
licencia bastantes departamentos de Física y Química de
Institutos de Enseñanza Secundaria. |
|